钻钼系催化剂主要用于石油炼制等工艺,从废钴钼催化剂(主要含有![]() 、CoS和
、CoS和![]() )中回收钴和钼的工艺流程如图:
)中回收钴和钼的工艺流程如图:
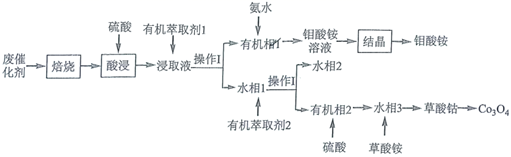
已知:浸取液中的金属离子主要为![]() 、
、![]() 、
、![]() 。
。
(1)钼酸铵![]() 中
中![]() 的化合价为________,
的化合价为________,![]() 在空气中高温焙烧产生两种氧化物:
在空气中高温焙烧产生两种氧化物:![]() 和________(填化学式)。
和________(填化学式)。
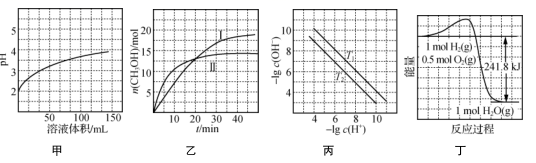
(2)为了加快酸浸速率,可采取的措施为________(任写一条)。
(3)若选择两种不同萃取剂按一定比例(协萃比)协同萃取![]() 和
和![]() ,萃取情况如图所示,当协萃比
,萃取情况如图所示,当协萃比![]() ________,更有利于
________,更有利于![]() 的萃取。
的萃取。

(4)操作Ⅰ的名称为________。
(5)向有机相1中滴加氨水,发生的离子方程式为________。
(6)![]() 萃取的反应原理为
萃取的反应原理为![]() ,向有机相2中加入
,向有机相2中加入![]() 能进行反萃取的原因是________(结合平衡移动原理解释)。
能进行反萃取的原因是________(结合平衡移动原理解释)。
(7)水相2中的主要溶质除了![]() ,还有________(填化学式)。
,还有________(填化学式)。
(8)![]() 可用作电极,若选用
可用作电极,若选用![]() 电解质溶液,通电时可转化为
电解质溶液,通电时可转化为![]() ,其电极反应式为________。
,其电极反应式为________。
答案
![]()
![]() 搅拌
搅拌 ![]() 分液
分液 ![]() 根据
根据![]() 可知,加入
可知,加入![]() ,
,![]() 增大,平衡向左移动
增大,平衡向左移动 ![]()
![]()
【分析】
从废钴钼催化剂(主要含有![]() 、CoS和
、CoS和![]() )经过焙烧后,得到
)经过焙烧后,得到![]() ,CoO和二氧化硫,加入硫酸后,浸取液中的金属离子主要为
,CoO和二氧化硫,加入硫酸后,浸取液中的金属离子主要为![]() 、
、![]() 、
、![]() ,经过萃取和分液得到有机相1和水相1,有机相1中含有
,经过萃取和分液得到有机相1和水相1,有机相1中含有![]() ,加入氨水后得到钼酸铵溶液,经结晶后得到钼酸铵;水相1中含有
,加入氨水后得到钼酸铵溶液,经结晶后得到钼酸铵;水相1中含有![]() 、
、![]() ,SO42-,经萃取分液后,水相2中含有
,SO42-,经萃取分液后,水相2中含有![]() 和
和![]() ,有机相2中含有
,有机相2中含有![]() 、SO42-,加入硫酸后,得到水相3,加入草酸铵,得到草酸钴,加热草酸钴可以得到四氧化三钴,据此分析解答。
、SO42-,加入硫酸后,得到水相3,加入草酸铵,得到草酸钴,加热草酸钴可以得到四氧化三钴,据此分析解答。
【详解】
(1)![]() 中,铵根离子为+1价,O为-2价,所有元素的化合价之和为0,Mo的化合价为+6,
中,铵根离子为+1价,O为-2价,所有元素的化合价之和为0,Mo的化合价为+6,![]() 和氧气反应的化学方程式为:2
和氧气反应的化学方程式为:2![]() +7O2=2
+7O2=2![]() +4SO2,可知生成物有二氧化硫和
+4SO2,可知生成物有二氧化硫和![]() 两种氧化物;
两种氧化物;
(2)为了加快酸浸速率,可采取的措施为搅拌,可以增大接触面积;
(3)根据图像,找到![]() 最多,
最多,![]() 较少的协萃比为4:1;
较少的协萃比为4:1;
(4)操作1是将有机相和水相分开,是分液;
(5)有机相1中含有![]() ,加入氨水后得到钼酸铵溶液,化学方程式为
,加入氨水后得到钼酸铵溶液,化学方程式为![]() ;
;
(6)根据![]() 可知,加入
可知,加入![]() ,
,![]() 增大,平衡向左移动,能进行反萃取;
增大,平衡向左移动,能进行反萃取;
(7)水相1中含有![]() 、
、![]() ,SO42-,经萃取分液后,水相2中含有
,SO42-,经萃取分液后,水相2中含有![]() 和
和![]() ;
;
(8)![]() 可以表示成
可以表示成![]() ,在碱性条件下可发生氧化反应,生成
,在碱性条件下可发生氧化反应,生成![]() ,电极反应为
,电极反应为![]() 。
。