中国古代成语蕴含着丰富的化学知识。下列说法错误的是
A.“甘之如饴”中“饴”指麦芽糖,与白糖的主要成分相同
B.“近朱者赤”中“朱”指朱砂(HgS),可用作红色颜料
C.“沙里淘金”利用了“沙”和“金”密度的差异进行分离
D.“红砖绿瓦”中“砖”和“瓦”都属于硅酸盐产品
A
【详解】
A.“甘之如饴”中“饴”指麦芽糖,白糖的主要成分是蔗糖,与白糖的主要成分不相同,故A错误;
B.朱砂(HgS)是红色固体,难溶于水,可用作红色颜料,故B正确;
C.“沙”和“金”密度的差异大,可用淘洗的方法进行分离,故C正确;
D.“砖”和“瓦”主要成分均为硅酸盐,都属于硅酸盐产品,故D正确;
故选A。
气相条件下,立方烷能自发地发生热重排反应生成一系列化合物。下列说法正确的是
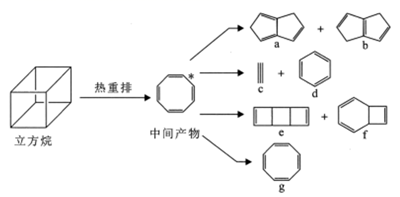
A.a、f中所有原子均可处于同一平面
B.1mol化合物e完全燃烧消耗12molO2
C.六硝基立方烷最多有3种结构(不考虑立体异构)
D.立方烷热重排产物均能使酸性KMnO4溶液褪色
C
【详解】
A.a、f中均有sp3杂化的碳原子,是四面体结构,所有原子不可能处于同一平面,故A错误;
B.1mol化合物e(C8H8)完全燃烧消耗为(8+![]() )mol=10molO2,故B错误;
)mol=10molO2,故B错误;
C.六硝基立方烷的同分异构相当于2个H原子的排列方式,有在同一棱上、面对角线上、体对角线上3种结构(不考虑立体异构),故C正确;
D.立方烷热重排产物中d是苯,不能使酸性KMnO4溶液褪色,故D错误;
故选C。
实验室制备莫尔盐![]() 的过程是:向稀H2SO4中加入过量的铁屑,充分反应后过滤,向滤液中加入一定量的(NH4)2SO4饱和溶液。经蒸发浓缩、冷却结晶、过滤,得到莫尔盐晶体。下列说法正确的是
的过程是:向稀H2SO4中加入过量的铁屑,充分反应后过滤,向滤液中加入一定量的(NH4)2SO4饱和溶液。经蒸发浓缩、冷却结晶、过滤,得到莫尔盐晶体。下列说法正确的是
A.铁屑上若有少量铁锈,将导致莫尔盐中混入杂质Fe2(SO4)3
B.蒸发浓缩使用的仪器有坩埚、玻璃棒、酒精灯
C.室温时,莫尔盐的溶解度比(NH4)2SO4和FeSO4的都小
D.晶体析出后,取少量母液加入![]() ,无蓝色沉淀生成
,无蓝色沉淀生成
C
【详解】
A.2Fe3++Fe=3Fe2+,故A错误;
B.蒸发浓缩使用的仪器有蒸发皿、玻璃棒、酒精灯,故B错误;
C.硫酸亚铁铵在水中的溶解度比组成它的每一种盐的溶解度都小,故C正确;
D.晶体析出后,取少量母液,其中含有Fe2+,加入![]() ,3Fe2++ 2
,3Fe2++ 2![]() =6K+ +
=6K+ +![]() ,有蓝色沉淀生成,故D错误;
,有蓝色沉淀生成,故D错误;
故选C。
硅是制作光伏电池的关键材料。在Si晶体中掺杂不同种类的元素,可形成多电子的n型或缺电子的p型半导体。n型和p型半导体相互叠加形成p-n结,此时自由电子发生扩散运动,在交界面处形成电场。下列说法正确的是
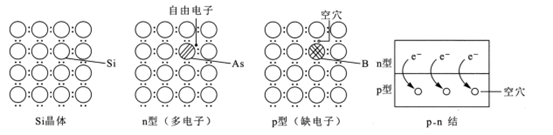
A.1molSi晶体中含有的Si-Si键数目为4NA
B.若在Si晶体中掺入P元素,可得n型半导体
C.p-n结中,n型一侧带负电,p型一侧带正电
D.光伏电池的能量转化形式为:光能→化学能→电能
B
【详解】
A.硅晶体中,一个硅原子与4个硅原子形成4个Si-Si键,一个Si-Si键2个硅原子共用,平均1molSi晶体中含有的Si-Si键数目为2NA,故A错误;
B.若在Si晶体中掺入P元素,P最外层是5个电子,可形成多电子的n型半导体,故B正确;
C.p-n结中,p型半导体的空穴浓度高,自由电子的浓度低,P型一侧带负电;而n型半导体的自由电子浓度高,空穴浓度低,N型一侧带正电,故C错误;
D.光伏电池是一种利用太阳光直接发电的光电半导体薄片,能量转化形式为:光能→电能,故D错误;
故选B。
主族元素W、X、Y、Z的原子序数依次增大,且均不大于20。X、Y同周期,X的最高正价与最低负价代数和为4。化合物ZW2与水剧烈反应,有易燃的单质气体产生,同时生成白色糊状物。下列说法正确的是
A.单质的沸点:W>Y B.化合物ZW2中只含有离子键
C.简单氢化物的热稳定性:X>Y D.X的氧化物的水化物均是强酸
B
【分析】
主族元素W、X、Y、Z的原子序数依次增大,且均不大于20。X、Y同周期,X的最高正价与最低负价代数和为4,X位于ⅥA族,为S元素,Y为Cl;化合物ZW2与水剧烈反应,有易燃的单质气体产生,同时生成白色糊状物,Z为钙,W为H,CaH2+2H2O=Ca(OH)2+H2↑。
【详解】
由分析:W为H,X为S,Y为Cl,Z为钙。
A.氢的相对分子质量小于氯气,单质的沸点:W<Y,故A错误;
B.化合物CaH2中只含有离子键,两个H原子间没有化学键,故B正确;
C.元素的非金属性越强,形成的气态氢化物就越稳定。同周期的非金属元素,从左到右,随核电荷数的增加,非金属性渐强,气态氢化物的稳定性渐强。非金属性:S<Cl,简单氢化物的热稳定性:X<Y,故C错误;
D.X的氧化物的水化物中H2SO3是弱酸,H2SO4是强酸,故D错误;
故选B。
【点睛】
本题考查物质结构性质的相互关系应用,推断元素为解答关键,注意掌握元素周期律内容及常见元素化合物性质,试题侧重考查学生的分析能力及逻辑推理能力,难点Z和W元素的推断:化合物ZW2与水剧烈反应,有易燃的单质气体产生,同时生成白色糊状物,明确发生的反应是CaH2+2H2O=Ca(OH)2+H2↑,Z为钙,W为H。
本卷还有19题,登录并加入会员即可免费使用哦~

该作品由: 用户张延侠分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。