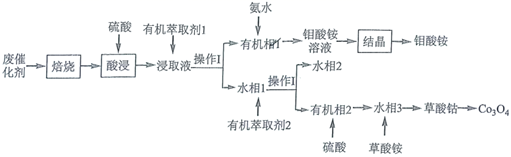
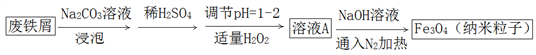根据下列图示所得出的结论正确的是( )
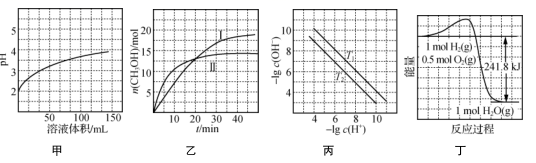
A.图甲表示1 mL pH=2某一元酸溶液加水稀释时,pH随溶液总体积的变化曲线,说明该酸是强酸
B.图乙表示恒容密闭容器中其他条件相同时改变温度,反应CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)中n(CH3OH)随时间的变化曲线,说明反应平衡常数KⅠ>KⅡ
CH3OH(g)+H2O(g)中n(CH3OH)随时间的变化曲线,说明反应平衡常数KⅠ>KⅡ
C.图丙表示不同温度下水溶液中-lg c(H+)、-lg c(OH-)变化曲线,说明T1>T2
D.图丁表示1 mol H2和0.5 mol O2反应生成1 mol H2O过程中的能量变化曲线,说明H2的燃烧热是241.8 kJ·mol-1
答案
B
【详解】
A. 图甲表示1 mL pH=2某一元酸溶液加水稀释时,pH随溶液总体积的变化曲线,当体积为100mL时,溶液体积增大100倍,pH<4,说明存在电离平衡,则该酸是弱酸,选项A错误;
B、根据图中信息可知曲线Ⅱ反应速率快,温度较高,升高温度,平衡时n(CH3OH)较小,则平衡向逆反应方向移动,平衡常数KⅠ>KⅡ,选项B正确;
C. 升高温度促进水的电离,c(H+)、c(OH-)增大,-lg c(H+)、-lg c(OH-)减小,图丙表示不同温度下水溶液中-lg c(H+)、-lg c(OH-)变化曲线,说明T1<T2,选项C错误;
D、在温度为25℃,压力为101kPa时,1 mol纯物质完全燃烧生成稳定的氧化物时所放出的热量为燃烧热,图中表示的是生成气态水,不是稳定氧化物,选项D错误;
答案选B。