2SO 2 (g)+O 2 (g) ![]() 2SO 3 (g) 反应过程中的能量变化如图所示(图中 E 1 表示无催化剂时正反应的活化能, E 2 表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是
2SO 3 (g) 反应过程中的能量变化如图所示(图中 E 1 表示无催化剂时正反应的活化能, E 2 表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是

A . 该反应的逆反应为吸热反应,升高温度可提高活化分子的百分数
B . 500℃、101kPa 下,将 1molSO 2 (g) 和 0.5molO 2 (g) 置于密闭容器中充分反应生成 SO 3 (g) 放热 akJ ,其热化学方程式为 2SO 2 (g)+O 2 (g) ![]() 2SO 3 (g) ΔH=-2a kJ·mol -l
2SO 3 (g) ΔH=-2a kJ·mol -l
C . 该反应中,反应物的总键能小于生成物的总键能
D . ΔH=E 1 -E 2 ,使用催化剂改变活化能,但不改变反应热
B
【解析】
试题分析:由图可知,该反应正反应为放热反应。 A. 该反应的逆反应为吸热反应,升高温度可提高活化分子的百分数 , A 正确; B. 500 ℃ 、 101kPa 下,将 1molSO 2 (g) 和 0.5molO 2 (g) 置于密闭容器中充分反应放热 a kJ, 由于该反应为可逆反应,得不到 1mol SO 3 (g), 所以热化学方程式 2SO 2 (g)+O 2 (g) ![]() 2SO 3 (g) 的反应热不等于 -2a kJ·mol -l , B 不正确; C. 该反应中为放热反应,其 ΔH<0, 所以反应物的总键能小于生成物的总键能 , C 正确; D. ΔH=E 1 -E 2 ,使用催化剂能改变反应的活化能,但不改变反应热 , D 正确。本题选 B。
2SO 3 (g) 的反应热不等于 -2a kJ·mol -l , B 不正确; C. 该反应中为放热反应,其 ΔH<0, 所以反应物的总键能小于生成物的总键能 , C 正确; D. ΔH=E 1 -E 2 ,使用催化剂能改变反应的活化能,但不改变反应热 , D 正确。本题选 B。
点睛:要注意可逆反应总有一定的限度,在一定的条件下,反应物不能完全转化为生成物,在计算反应热时要注意这一点。
MgCO 3 和 CaCO 3 的能量关系如图所示 (M = Ca 、 Mg) :
M 2+ (g) + CO 3 2- (g) ![]() M 2+ (g) + O 2− (g) + CO 2 (g)
M 2+ (g) + O 2− (g) + CO 2 (g)
![]()
![]()
![]()
已知:离子电荷相同时,半径越小,离子键越强。下列说法 不正确 的是
A . Δ H 1 (MgCO 3 ) > Δ H 1 (CaCO 3 ) > 0
B . Δ H 2 (MgCO 3 ) = Δ H 2 (CaCO 3 ) > 0
C . Δ H 1 (CaCO 3 ) - Δ H 1 (MgCO 3 ) = Δ H 3 (CaO) - Δ H 3 (MgO)
D . 对于 MgCO 3 和 CaCO 3 , Δ H 1 + Δ H 2 > Δ H 3
C
【详解】
根据盖斯定律,得 ΔH=ΔH 1 +ΔH 2 +ΔH 3 , 又易知 Ca 2+ 半径大于 Mg 2+ 半径,所以 CaCO 3 的离子键强度弱于 MgCO 3 ,CaO 的离子键强度弱于 MgO 。
A. ΔH 1 表示断裂 CO 3 2- 和 M 2+ 的离子键所吸收的能量,离子键强度越大,吸收的能量越大,因而 ΔH 1 (MgCO 3 ) > ΔH 1 (CaCO 3 ) > 0,A 项正确;
B. ΔH 2 表示断裂 CO 3 2- 中共价键形成 O 2− 和 CO 2 吸收的能量,与 M 2+ 无关,因而 ΔH 2 (MgCO 3 ) = ΔH 2 (CaCO 3 ) > 0,B 项正确;
C. 由上可知 ΔH 1 (CaCO 3 )-ΔH 1 (MgCO 3 )<0, 而 ΔH 3 表示形成 MO 离子键所放出的能量, ΔH 3 为负值, CaO 的离子键强度弱于 MgO ,因而 ΔH 3 (CaO)>ΔH 3 (MgO),ΔH 3 (CaO)-ΔH 3 (MgO)>0,C 项错误;
D. 由上分析可知 ΔH 1 +ΔH 2 >0 , ΔH 3 <0 ,故 ΔH 1 + ΔH 2 > ΔH 3 , D 项正确。
故答案选 C 。
下列有关说法正确的是
A . 已知 HI(g) ![]() 1/2H 2 (g) + 1/2I 2 (s) Δ H =- 26.5 kJ·mol - 1 ,由此可知 1 mol HI 气体在密闭容器中充分分解后可以放出 26.5 kJ 的热量
1/2H 2 (g) + 1/2I 2 (s) Δ H =- 26.5 kJ·mol - 1 ,由此可知 1 mol HI 气体在密闭容器中充分分解后可以放出 26.5 kJ 的热量
B . 已知 2H 2 (g) + O 2 (g)===2H 2 O(g) Δ H =- 571.6 kJ·mol - 1 ,则氢气的燃烧热为 Δ H =- 285.8 kJ·mol - 1
C . 已知 2C(s) + 2O 2 (g)=2CO 2 (g) Δ H 1 , 2C(s) + O 2 (g)=2CO(g) Δ H 2 ,则 Δ H 1 < Δ H 2
D . 含 20.0 g NaOH 的稀溶液与稀盐酸完全中和,放出 28.7 kJ 的热量,则稀醋酸和稀 NaOH 溶液反应的热化学方程式为: NaOH(aq) + CH 3 COOH(aq)===CH 3 COONa(aq) + H 2 O(l) Δ H =- 57.4 kJ·mol - 1
C
【详解】
A. HI(g) ![]() 1/2H 2 (g)+1/2I 2 (s) Δ H =- 26.5 kJ·mol - 1 ,由于反应可逆,可知 1 mol HI气体充分分解后可以放出小于26.5 kJ的热量,故A错误;
1/2H 2 (g)+1/2I 2 (s) Δ H =- 26.5 kJ·mol - 1 ,由于反应可逆,可知 1 mol HI气体充分分解后可以放出小于26.5 kJ的热量,故A错误;
B.根据燃烧热定义可知,水的状态不对,必须为液态才可以,故B错误;
C.已知2C(s)+2O 2 (g)=2CO 2 (g) Δ H 1 , 2C(s)+O 2 (g)=2CO(g) Δ H 2 ,盖斯定律可得: 2CO(g)+O 2 (g)= 2CO 2 (g) Δ H 1 -Δ H 2 ,因为燃烧放热,所以Δ H 1 -Δ H 2 < 0, 则Δ H 1 < Δ H 2 ,故 C正确;
D.因为醋酸为弱电解质,电离需要吸热,所以NaOH(aq)+CH 3 COOH(aq)==CH 3 COONa(aq)+H 2 O(l) ΔH>-57.4 kJ·mol-1,故D错误;
正确答案 :C。
【点睛】
①关于可逆反应热化学方程式注意点:
A.当反应逆向进行,其反应热与正反应的反应热数值相等,符号相反。
B.2SO 2 (g)+O 2 (g) ![]() 2SO 3 (g) ΔH =- a kJ·mol - 1 ,意义是指 2 mol SO 2 气体与 1 mol O 2 完全反应时,放出 a kJ的热量,若将2 mol SO 2 与气体 1 mol O 2 放于一密闭容器中在一定条件下反应达平衡时,放出的热量要小于 a kJ,且当平衡移动(各物质状态不变)时, ΔH 不变。
2SO 3 (g) ΔH =- a kJ·mol - 1 ,意义是指 2 mol SO 2 气体与 1 mol O 2 完全反应时,放出 a kJ的热量,若将2 mol SO 2 与气体 1 mol O 2 放于一密闭容器中在一定条件下反应达平衡时,放出的热量要小于 a kJ,且当平衡移动(各物质状态不变)时, ΔH 不变。
②燃烧热定义:101KPa时,1 mol纯物质完全燃烧生成生成稳定氧化物时所放出的热量;例如氢元素对应液态水,硫元素对应二氧化硫等
中和热定义:稀溶液中强酸跟强碱发生中和反应只生成 1 mol H 2 O时所释放的热量;不同反应物的中和热大致相同,均约为57.3kJ·mol - 1
下图是 2SO 3 (g) ![]() 2SO 2 (g)+O 2 (g)的能量变化图,据图得出的相关叙述 正确 的是 ( )
2SO 2 (g)+O 2 (g)的能量变化图,据图得出的相关叙述 正确 的是 ( )
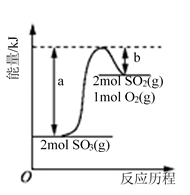
A . 该化学反应过程中既有能量的吸收又有能量的释放
B . 2SO 3 (g) ![]() 2SO 2 (g)+O 2 (g) △H=-( a - b ) kJ/mol
2SO 2 (g)+O 2 (g) △H=-( a - b ) kJ/mol
C . 1 mol SO 2 的能量比 1 mol SO 3 的能量高
D . 若某容器内有 2 mol SO 3 充分反应,吸收 ( a - b ) kJ热量
A
【详解】
A . 断键需要吸热,形成化学键需要放热,则该化学反应过程中既有能量的吸收又有能量的释放, A 正确;
B . 反应热等于断键吸收的总能量和形成化学键所放出的总能量的差值,则根据图像可知反应 2SO 3 ( g ) ![]() 2SO 2 ( g )+ O 2 ( g )的△ H = ( a - b ) kJ / mol , B 错误;
2SO 2 ( g )+ O 2 ( g )的△ H = ( a - b ) kJ / mol , B 错误;
C . 根据图像可知 0 . 5mol 氧气和 1 mol SO 2 的总能量比 1 mol SO 3 的能量高,二氧化硫和三氧化硫的能量不能比较, C 错误;
D . 由于是可逆反应,转化率达不到 100 %,因此若某容器内有 2 mol SO 3 充分反应,吸收的热量小于 ( a - b ) kJ , D 错误。
答案选 A 。
已知:
下列说法正确的是
A . ∆H 1 <0 , ∆H 2 <0 , ∆H 3 <∆H 4 B . 6∆H 1 +∆H 2 +∆H 3 -∆H 4 =0
C . -6∆H 1 +∆H 2 +∆H 3 -∆H 4 =0 D . -6∆H 1 +∆H 2 -∆H 3 +∆H 4 =0
B
【详解】
物质由气态转化为液态(液化)需要放热,物质由固态转化为气态需要吸热,比较反应 3 和反应 4 中 C 6 H 12 O 6 ( s) → C 6 H 12 O 6 ( g )为吸热过程, 6H 2 O(g) → 6 H 2 O(l) 为放热过程,所以反应 4 放出更多能量, △ H 更小,故 △ H 3 > △H 4 , 选项 A 错误;由盖斯定律知,反应 1 的 6 倍与反应 2 与反应 3 的和可以得到反应 4 ,即 6△H 1 + △H 2 + △H 3 = △H 4 ,经数学变形,可以得到 6△H 1 + △H 2 +△H 3 - △H 4 = 0, 选项 B 正确;选项 C、D 均错误。答案选 B。
【点睛】
本题考查热化学方程式的书写,难度不大,注意书写燃烧热的热化学方程式时可燃物一定是 1 mol ,即可燃物的计量系数一定是 1。
本卷还有95题,登录并加入会员即可免费使用哦~

该作品由: 用户邓芳分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。