3- 氧代异紫杉二酮是从台湾杉中提取的具有抗痛活性的天然产物。最近科学家完成了该物质的全合成,其关键中间体 (F) 的合成路线如下:
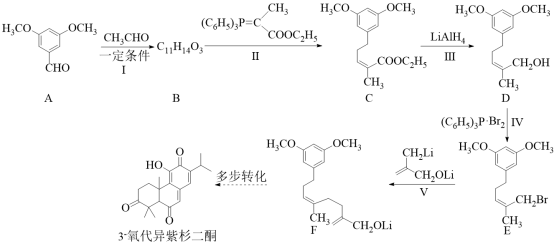
已知: 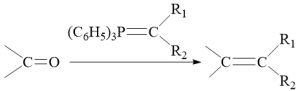
回答下列问题:
(1)A 的含氧官能团有醛基和 。
(2)B 的结构简式为 。
(3)Ⅳ 的反应类型为 ;由 D 转化为 E 不能使用 的原因是 。
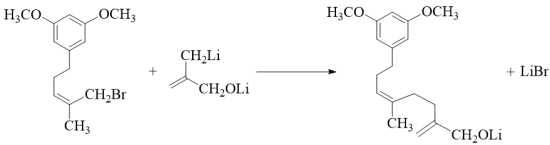
(4) 反应 Ⅴ 的化学方程式为 。
(5) 化合物 Y 是 A 的同分异构体,同时满足下述条件:
①Y 的核磁共振氢谱有 4 组峰,峰而积之比为 。
②Y 在稀硫酸条件下水解,其产物之一 ( 分子式为 ) 遇
溶液显紫色。则 Y 的结构简式为 。
(1) 醚键 ( 或醚基 )
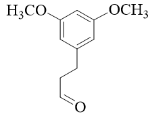
(2) 
(3) 取代反应 会与碳碳双键发生加成反应 ( 或
会使醚键水解 )
(4) 
(5) 
【分析】有机合成可从正向和逆向共同进行推断,根据已知信息由 C 可推出 B 为 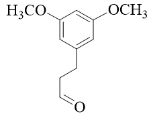 ,根据 C 到 D 的结构变化可知此步酯基发生水解反应,根据 D 到 E 的结构可知此步 Br 取代了羟基,根据 E 到 F 的结构可知脱去 LiBr ,为取代反应,据此进行推断。
,根据 C 到 D 的结构变化可知此步酯基发生水解反应,根据 D 到 E 的结构可知此步 Br 取代了羟基,根据 E 到 F 的结构可知脱去 LiBr ,为取代反应,据此进行推断。
【详解】( 1 ) A 的含氧官能团有醛基和醚键。
( 2 )根据分析可知, B 的结构简式为 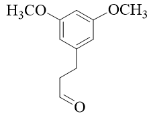 。
。
( 3 )反应 Ⅳ 中 Br 取代了羟基,为取代反应,此反应不用 HBr 的原因为 会与碳碳双键发生加成反应 ( 或
会使醚键水解 ) 。
( 4 )反应 Ⅴ 的化学方程式为  。
。
( 5 )产物之一 ( 分子式为 ) 遇
溶液显紫色,说明含有酚羟基,酚羟基是通过酯基水解得来的,又因为核磁共振氢谱有 4 组峰,峰而积之比为
,说明 Y 有两个甲基,综合可知 Y 的结构简式为
 。
。
某非线性光学晶体由钾元素 (K) 和原子序数依次增大的 X 、 Y 、 Z 、 W 四种短周期元素组成。 X 与 Y 、 Z 与 W 均为同周期相邻元素, X 的核外电子总数为最外层电子数的 2 倍, Z 为地壳中含量最多的元素。下列说法正确的是
A .简单氢化物沸点: B .
分子的空间构型为三角锥形
C .原子半径: D .最高价氧化物对应水化物的碱性:
A
【分析】 X 的核外电子总数为最外层电子数的 2 倍, X 为 Be ; Z 为地壳中含量最多的元素, Z 为 O , X 与 Y 、 Z 与 W 均为同周期相邻元素, Y 为 B , W 为 F ,据此解答。
【详解】 A . 常温下为液态, HF 常温下为气体,沸点
,故 A 正确;
B . 为 BF 3 ,中心 B 原子有 3 对价电子且没有孤电子对,空间构型为平面三角形,故 B 错误;
C .四种元素为同周期元素,随核电荷数增大原子半径减小,原子半径: Be>B>O>F ,故 C 错误;
D . Be 最高价氧化物水化物为 Be(OH) 2 ,溶液显两性, B 最高价氧化物的水化物为 H 3 BO 3 ,溶液显酸性,故 D 错误;
故选: A 。
锂辉石是锂的重要来源,其焙烧后的酸性浸出液中含有 和
杂质离子,可在 0~14 范围内调节
对其净化 ( 即相关离子浓度
) 。
时,
与
关系见下图 ( 碱性过强时
和
会部分溶解 ) 。下列说法正确的是
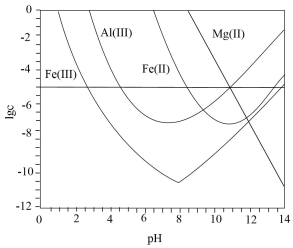
A . 可被净化的
区间最大
B .加入适量 ,可进一步提升净化程度
C .净化的先后顺序:
D .
B
【详解】 A .对离子净化时,相关离子浓度 c <10 -5 mol/L ,则 lg c <-5 ,由图可知,可作净化的 pH 区间最大的是 Fe 3+ , A 错误;
B .加入适量 H 2 O 2 ,可将 Fe 2+ 氧化为 Fe 3+ ,提高净化程度, B 正确;
C .由图可知,净化的先后顺序为 , C 错误;
D .对离子净化时,相关离子浓度 c <10 -5 mol/L , lg c <-5 ,,由图可知, Fe 3+ 完全沉淀的 pH 约为 2.5 , c (H + )=10 -2.5 mol/L , c (OH - )=10 -11.5 mol/L , , Al 3+ 完全沉淀的 pH 约为 4.5 , c (H + )=10 -4.5 mol/L , c (OH - )=10 -9.5 mol/L ,
, Fe 2+ 完全沉淀的 pH 约为 8.5 , c (H + )=10 -8.5 mol/L , c (OH - )=10 -5.5 mol/L ,
,则有
, D 错误;
故选 B 。
某兴趣小组设计实验探究 ,催化空气氧化
的效率。回答下列问题:
步骤 Ⅰ 制备
在通风橱中用下图装置制备 ( 加热及夹持装置省略 ) ,反应方程式:
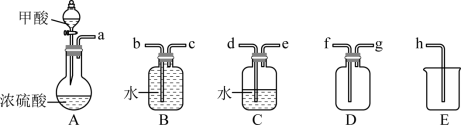
(1) 装置 A 中盛放甲酸的仪器的名称是 。
(2) 从 B 、 C 、 D 中选择合适的装置收集 ,正确的接口连接顺序为 a→_______→_______→_______→_______→h( 每空填一个接口标号 ) 。
步骤 Ⅱ 检验
将 通入新制银氨溶液中,有黑色沉淀生成。
(3) 该反应的化学方程式为 。
步骤 Ⅲ 探究 催化空气氧化
的效率
将一定量 与空气混合,得到
体积分数为 1% 的气体样品。使用下图装置 ( 部分加热及夹持装置省略 ) ,调节管式炉温度至
,按一定流速通入气体样品。 ( 已知:
是白色固体,易吸水潮解:
)
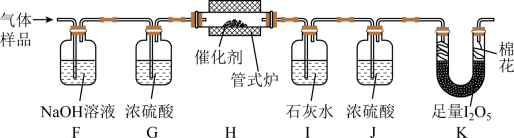
(4) 通入 ( 已折算为标况 ) 的气体样品后,继续向装置内通入一段时间氮气,最终测得 U 形管内生成了
。
① 能证明 被空气氧化的现象是 ;
② 被催化氧化的百分率为 ;
③ 若未通入氮气, ② 的结果将 ( 填 “ 偏大 ”“ 偏小 ” 或 “ 无影响 ”) 。
(5) 探究气体与催化剂接触时长对催化氧化效率的影响时,采用 方法可以缩短接触时长。
(6) 步骤 Ⅲ 装置存在的不足之处是 。
(1) 分液漏斗
(2)a→d→e→c→b
(3)
(4) 石灰水变浑浊 60% 偏大
(5) 增大气体样品流速
(6) 尾气出口未加防潮装置 ( 或其他相似表述 )
【分析】在通风橱中用下图装置制备一氧化碳,用 A 装置制取一氧化碳,该气体中含有甲酸蒸气,故用水除去甲酸,再用 B 装置排水收集一氧化碳气体,排出的水用 E 中的烧杯接收。根据气体样品通过氢氧化钠吸收空气中的二氧化碳,浓硫酸吸水,一氧化碳在 H 中被氧气氧化生成二氧化碳,二氧化碳能被石灰水吸收, J 中的浓硫酸吸收气体中的水蒸气,干燥的一氧化碳和 ,进而测定生成的碘的质量,计算一氧化碳的被氧化的百分率。据此解答。
【详解】( 1 )装置 A 中盛放甲酸的仪器为分液漏斗。
( 2 )用 C 除去甲酸, B 收集一氧化碳, E 接收排出的水,故接口连接顺序为 a→d→e→c→b→h 。
( 3 )一氧化碳和银氨溶液反应生成黑色的银,同时生成碳酸铵和氨气,方程式为: 。
( 4 )一氧化碳被氧气氧化生成二氧化碳,能使澄清的石灰水变浑浊。碘的物质的量为 ,则结合方程式分析,还有 0.002mol 一氧化碳未被氧气氧化, 11.2L 气体为 0.5mol 其中一氧化碳为 0.005mol ,则被氧化的一氧化碳为 0.005-0.002=0.003mol ,则被氧化的百分率为
。如果没有通入氮气则计算的未被氧化的一氧化碳的物质的量减少,则被氧化的百分率增大。
( 5 )增大气流速率可以提高催化效率。
( 6 ): 是白色固体,易吸水潮解,但该装置出气口未加防潮装置。
1962 年首个稀有气体化合物 问世,目前已知的稀有气体化合物中,含氙 ( 54 Xe) 的最多,氪 ( 36 Kr) 次之,氩 ( 18 Ar) 化合物极少。
是
与
分子形成的加合物,其晶胞如下图所示。
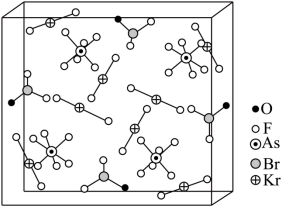
回答下列问题:
(1) 基态 原子的价电子排布式为 。
(2) 原子的活泼性依序增强,原因是 。
(3) 晶体熔点:
( 填 “>”“<” 或 “=”) ,判断依据是 。
(4) 的中心原子
的杂化轨道类型为 。
(5) 加合物中
,晶体中的微粒间作用力有 ( 填标号 ) 。
a. 氢键 b. 离子键 c. 极性共价键 d. 非极性共价键
(1)
(2) 同族元素,从上而下原子半径逐渐增大,原子核对外层电子的有效吸引逐渐减弱,失电子能力逐渐增强
(3) < 二者为同构型的分子晶体, 相对分子质量大,范德华力大,熔点高
(4)
(5) 2 bc
【详解】( 1 ) 位于元素周期表中第四周期 VA 族,原子序数为 33 ,由构造原理写出其价电子排布式为
。
( 2 )同族元素,从上而下原子半径逐渐增大,原子核对外层电子的有效吸引逐渐减弱,失电子能力逐渐增强,故 原子的活泼性依序增强。
( 3 ) 和
是同构型的分子晶体,
相对分子质量大,范德华力大,熔点高,晶体熔点:
<
。
( 4 ) 的中心原子
的价层电子对数为: 3+
=4 ,杂化轨道类型为
。
( 5 )由晶胞结构可知,其中含有 8 个 、 4 个
、 4 个
,则
加合物中
2 ,晶体中的微粒间作用力有离子键、极性共价键,故选 bc 。
用铬铁合金 ( 含少量 单质 ) 生产硫酸铬的工艺流程如下:
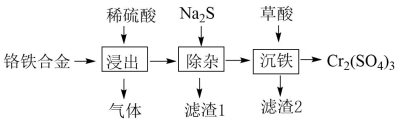
下列说法 错误 的是
A . “ 浸出 ” 产生的气体含有 B . “ 除杂 ” 的目的是除去
元素
C .流程中未产生六价铬化合物 D . “ 滤渣 2” 的主要成分是
D
【分析】由流程可知,加入稀硫酸溶解,生成气体为氢气,溶液中含 加入 Na 2 S 分离出滤渣 1 含 CoS 和 NiS ,
不会沉淀,再加入草酸除铁生成 FeC 2 O 4 ,过滤分离出硫酸铬,以此来解答。
【详解】 A .四种金属均与稀硫酸反应生成 H 2 , A 正确;
B .共有四种金属,由流程可知,沉铁后分离出硫酸铬,则 “ 除杂 " 的目的是除去 Ni 、 Co 元素, B 正确;
C .由上述分析可知,流程中未产生六价铬化合物, C 正确;
D . “ 滤渣 2” 的主要成分是 FeC 2 O 4 , D 错误;
故本题选 D 。
探究醋酸浓度与电离度 关系的步骤如下,与相关步骤对应的操作或叙述正确的
| | 步骤 | 操作或叙述 |
| A | Ⅰ. 用 | 滴定时应始终注视滴定管中的液面 |
| B | Ⅱ. 用标定后的溶液配制不同浓度的醋酸溶液 | 应使用干燥的容量瓶 |
| C | Ⅲ. 测定步骤 Ⅱ 中所得溶液的 | 应在相同温度下测定 |
| D | Ⅳ. 计算不同浓度溶液中醋酸的电离度 | 计算式为 |
A . A B . B C . C D . D
C
【详解】 A .中和滴定时眼睛应始终注视锥形瓶内溶液颜色的变化, A 错误;
B .配制不同浓度的醋酸溶液时,容量瓶不需要干燥, B 错误;
C .温度影响醋酸的电离平衡,因此测定步骤 Ⅰ 中所得溶液的 时应在相同温度下测定, C 正确;
D .电离度是指弱电解质在溶液里达电离平衡时,已电离的电解质分子数占原来总分子数(包括已电离的和未电离的)的百分数,因此醋酸的电离度计算式为 , D 错误;
答案选 C 。
常温常压下,电化学还原制氨气的总反应方程式: ,设
为阿伏加德罗常数的值,下列说法正确的是
A . 水中含有的孤电子对数为
B .每产生 失去的电子数为
C . 氨水中,含有的
分子数少于
D .消耗 ( 已折算为标况 ) 时,产生的
分子数为
D
【详解】 A . H 2 O 分子中孤电子对数为 =2 ,
H 2 O 的物质的量为
=0.5mol ,含有的孤电子对数为
,故 A 错误;
B .该反应中 N 2 中 N 元素化合价由 0 价下降到 -3 价, 34g 的物质的量为
=2mol ,每产生
,
得到 6mol 电子,数目为 6N A ,故 B 错误;
C .氨水的体积未知,无法计算 的分子数,故 C 错误;
D . 的物质的量为 0.5mol ,由方程式可知,消耗 0.5mol
,产生的 0.75mol
,数目为
,故 D 正确;
故选 D 。
异丙醇 可由生物质转化得到,催化异丙醇脱水制取高值化学品丙烯
的工业化技术已引起人们的关注,其主要反应如下:
Ⅰ.
Ⅱ.
回答下列问题:
(1) 已知 ,则
燃烧生成
和
的热化学方程式为 。
(2) 在 下,刚性密闭容器中的反应体系内水蒸气浓度与反应时间关系如下表:
| 反应时间 | 0 | 4 | 8 | 12 | t | 20 |
| | 0 | 2440 | 3200 | 3600 | 4000 | 4100 |
① 内,
;
②t 16( 填 “>”“<” 或 “=”) 。
(3) 在恒温刚性密闭容器中,反应 Ⅰ 、 Ⅱ 均达到平衡的判据是 ( 填标号 ) 。
a. 的分压不变 b. 混合气体密度不变
c. d.
(4) 在一定条件下,若反应 Ⅰ 、 Ⅱ 的转化率分别为 98% 和 40% ,则丙烯的产率为 。
(5) 下图为反应 Ⅰ 、 Ⅱ 达到平衡时 与温度的关系曲线。
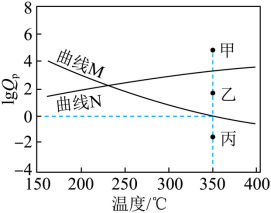
( 已知:对于可逆反应 ,任意时刻
,式中
) 表示物质 × 的分压 )
① 在 恒压平衡体系中充入少量水蒸气时,反应 Ⅰ 的的状态最有可能对应图中的 点 ( 填 “ 甲 ”“ 乙 ” 或 “ 丙 ”) ,判断依据是 。
② 时,在密闭容器中加入一定量的
,体系达到平衡后,测得
的分压为
,则水蒸气的分压为
( 用含 x 的代数式表示 ) 。
(1)
(2) 190 >
(3)ad
(4)58.8%
(5) 甲 反应 I 平衡曲线为 N ,恒压时充入水蒸气,
【详解】( 1 )设 Ⅲ ,根据盖斯定律 Ⅲ-2×Ⅰ 得
。
( 2 ) ① 内,
,则
;
② 、
、
, △ c (H 2 O) 逐渐减小,说明反应速率减小,
内, Δ c (H 2 O)=400ppm ,
内, Δ c (H 2 O)=400ppm ,则 t-12>4 ,即 t>16 。
( 3 ) a . H 2 O 的分压不变,则 C 3 H 6 的分压也不变,反应 1 、 Ⅱ 各组分分压不变,反应 1 、 Ⅱ 均达到平衡, a 正确;
b .反应物和生成物均为气体,混合气体的总质量不变,刚性密闭容器体积不变,则混合气体密度不变,不能作为反应 I 、 Ⅱ 均达到平衡的判据, b 错误;
c .当 时,反应不一定达到平衡,不能作为反应 1 、 Ⅱ 均达到平衡的判据, c 错误;
d . ,说明正逆反应速率相等,反应 I 达平衡,各组分分压不变, C 3 H 6 的分压不变,说明反应 Ⅱ 也达平衡, d 正确;
故选 ad 。
( 4 )设 C 3 H 8 O 的物质的量为 1mol ,若 lmol C 3 H 8 O 完全反应,理论上生成 1mol C 3 H 6 ,因为反应 Ⅰ 、 Ⅱ 的转化率分别为 98% 和 40% ,反应 I 生成 1mol×98%=0.98mol C 3 H 6 ,反应 Ⅱ 消耗了 40% C 3 H 6 ,则达平衡时 C 3 H 6 的物质的量为 0.98mol×(1-40%)=0.588mol ,所以丙烯的产率为 =58.8% 。
( 5 ) ① 反应 I 为气体体积增大的吸热反应,反应 Ⅱ 为气体体积减小的放热反应,则升高温度,反应 I 正向移动, 逐渐增大,反应 Ⅱ 逆向移动,
逐渐减小,即反应 I 为平衡曲线为 N ,反应 Ⅱ 平衡曲线为 M ;在 350℃ 恒压平衡体系中充入少量水蒸气时,对于反应 I 而言,相当于增大生成物浓度,使得
>
,即 lg
增大,反应 I 的状态最有可能对应图中的甲;
② 由图可知, 350°C 时达平衡后, =0 ,则 350℃ 时
=
=1 ,设水蒸气的平衡分压为 a MPa ,则反应 II 的 C 3 H 6 起始分压为 a MPa ,对反应 Ⅱ 列三段式有
,解得 a=
MPa 。
粉煤灰是火电厂的大宗固废。以某电厂的粉煤灰为原料 ( 主要含 和
等 ) 提铝的工艺流程如下:
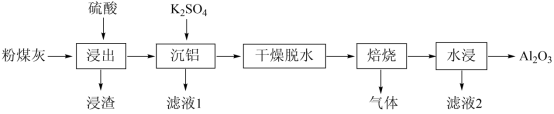
回答下列问题:
(1)“ 浸出 ” 时适当升温的主要目的是 , 发生反应的离子方程式为 。
(2)“ 浸渣 ” 的主要成分除残余 外,还有 。实验测得,
粉煤灰 (
的质量分数为
) 经浸出、干燥后得到
“ 浸渣 ”(
的质量分数为
) ,
的浸出率为 。
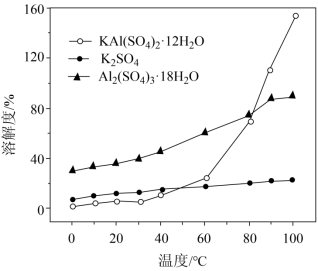
(3)“ 沉铝 ” 时,体系中三种物质的溶解度曲线如下图所示,加入 沉铝的目的是 , “ 沉铝 ” 的最佳方案为 。
(4)“ 焙烧 ” 时,主要反应的化学方程式为 。
(5)“ 水浸 ” 后得到的 “ 滤液 2” 可返回 工序循环使用。
(1) 提高浸出率 ( 或提高浸出速率 )
(2) 和
84%
(3) 使更多的铝元素转化为晶体析出,同时保证晶体纯度 高温溶解再冷却结晶
(4) 或
(5) 沉铝
【分析】粉煤灰为原料 ( 主要含 SiO 2 、 Al 2 O 3 和 CaO 等 ) 加入硫酸,浸渣为二氧化硅、硫酸钙,加入硫酸钾,产生复盐明矾沉铝,干燥脱水,焙烧产生氧化铝、硫酸钾和二氧化硫或三氧化硫气体,水浸除去硫酸钾,得到氧化铝。
【详解】( 1 )温度高速率大, “ 浸出 ” 时适当升温的主要目的是提高反应速率,提高浸出率; Al 2 O 3 和 H 2 SO 4 发生反应生成 Al 2 (SO 4 ) 3 和 H 2 O ,离子反应方程式为 Al 2 O 3 +6H + =2Al 3+ +3H 2 O ;
故答案为:提高浸出率 ( 或提高浸出速率 ) ; Al 2 O 3 +6H + =2Al 3+ +3H 2 O 。
( 2 ) “ 浸渣 ” 的主要成分除残余 Al 2 O 3 外,还有二氧化硅、硫酸钙; 5.0g 粉煤灰 Al 2 O 3 的质量为 5.0g×30%=1.5g , 3.0g“ 浸渣 ”Al 2 O 3 的质量为 3.0g×8%=0.24g ,则 Al 2 O 3 的浸出率为 ;
故答案为: SiO 2 和 CaSO 4 ; 84% 。
( 3 )根据沉铝体系中, Al 2 (SO 4 ) 3 ·18H 2 O 溶解度最大, KAl(SO 4 ) 2 ·12H 2 O 溶解度最小,更容易析出,加入 K 2 SO 4 沉铝的目的是更多的使 Al 2 (SO 4 ) 3 转化为 KAl(SO 4 ) 2 ·12H 2 O ,使更多的铝元素转化为晶体析出,同时保证晶体纯度; KAl(SO 4 ) 2 ·12H 2 O 溶解度受温度影响较大, “ 沉铝 ” 的最佳方案为高温溶解再冷却结晶;
故答案为:使更多的铝元素转化为晶体析出,同时保证晶体纯度;高温溶解再冷却结晶。
( 4 ) “ 焙烧 ” 时, KAl(SO 4 ) 2 分解为 K 2 SO 4 、 Al 2 O 3 和 SO 3 或 K 2 SO 4 、 Al 2 O 3 、 SO 2 和 O 2 ,反应方程式为 2KAl(SO 4 ) 2 K 2 SO 4 +Al 2 O 3 +3SO 3 ↑ 或 4KAl(SO 4 ) 2
2K 2 SO 4 +2Al 2 O 3 +6SO 2 ↑+3O 2 ↑ ;
故答案为: 2KAl(SO 4 ) 2 K 2 SO 4 +Al 2 O 3 +3SO 3 ↑ 或 4KAl(SO 4 ) 2
2K 2 SO 4 +2Al 2 O 3 +6SO 2 ↑+3O 2 ↑ 。
( 5 ) “ 水浸 ” 后得到的 “ 滤液 2” 成分为 K 2 SO 4 ,可在沉铝工序循环使用;
故答案为:沉铝。
氨是水体污染物的主要成分之一,工业上可用次氯酸盐作处理剂,有关反应可表示为:
①
②
在一定条件下模拟处理氨氮废水:将 的氨水分别和不同量的
混合,测得溶液中氨去除率、总氮 ( 氨氮和硝氮的总和 ) 残余率与
投入量 ( 用 x 表示 ) 的关系如下图所示。下列说法正确的是
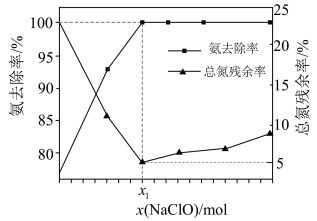
A . 的数值为 0.009
B . 时,
C . 时, x 越大,生成
的量越少
D . 时,
C
【详解】 A . x 1 时,氨的去除率为 100% 、总氮残留率为 5 ,
, 95% 的氨气参与反应 ① 、有 5% 的氨气参与反应 ② ,反应 ① 消耗
,参与反应 ② 消耗
,
, A 错误;
B . x>x 1 时,反应 ① 也生成氯离子,所以 , B 错误;
C . x>x 1 时, x 越大,氨总去除率不变,氮残余率增大,说明生成的硝酸根离子越多,生成 N 2 的量越少, C 正确;
D . x=x 1 时,氨的去除率为 100% ,溶液中没有 和 ClO - ,含有 Na + 、 H + 、
、 Cl - 和 OH - ,根据电荷守恒得
, D 错误;
故本题选 C 。
络塞维是中药玫瑰红景天中含有的一种天然产物,分子结构见下图。关于该化合物下列说法正确的是
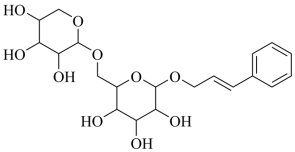
A .不能发生消去反应 B .能与醋酸发生酯化反应
C .所有原子都处于同一平面 D . 络塞维最多能与
反应
B
【详解】 A .该化合物的分子中,与羟基相连的碳原子的邻位碳原子上有氢原子,可发生消去反应, A 错误;
B .该化合物含有羟基,可与醋酸发生酯化反应, B 正确;
C .该化合物的结构中含有饱和碳原子,不可能所有原子处于同一平面上, C 错误;
D . 络塞维最多能与
反应,其中苯环消耗 3mol H 2 ,碳碳双键消耗 1mol H 2 , D 错误;
故选 B 。
福建多个科研机构经过长期联合研究发现,使用 和改性的
基催化剂,可打通从合成气经草酸二甲酯常压催化加氢制备乙二醇的技术难关。下列说法正确的是
A .草酸属于无机物 B . 与石墨互为同分异构体
C . 属于过渡元素 D .催化剂通过降低焓变加快反应速率
C
【详解】 A .草酸属于二元弱酸,即乙二酸,属于有机物, A 错误;
B . C 60 与石墨是碳元素的不同单质,互为同素异形体, B 错误;
C . Cu 为 ⅠB 族,属于过渡元素, C 正确;
D .催化剂通过降低反应的活化能加快反应速率,反应焓变不变, D 错误;
故选 C 。
实验室需对少量污染物进行处理。以下处理方法和对应的反应方程式 均错误 的是
A .用硫磺处理洒落在地上的水银:
B .用盐酸处理银镜反应后试管内壁的金属银:
C .用烧碱溶液吸收蔗糖与浓硫酸反应产生的刺激性气体:
D .用烧碱溶液吸收电解饱和食盐水时阳极产生的气体:
B
【详解】 A . S 和 Hg 发生化合反应生成 HgS ,可以用硫磺处理洒落在地上的水银,方程式为: ,处理方法和对应的反应方程式正确,不合题意;
B . Ag 不活泼,不能和盐酸反应生成氢气,处理方法和对应的反应方程式均错误,符合题意;
C .蔗糖与浓硫酸反应产生的刺激性气体为 SO 2 ,可以用 NaOH 溶液吸收 SO 2 ,离子方程式为: ,处理方法和对应的反应方程式均正确,不符合题意;
D .电解饱和食盐水时阳极产生的气体为 Cl 2 ,可以用 NaOH 溶液吸收 Cl 2 ,离子方程式为: ,处理方法和对应的反应方程式均正确,不符合题意;
故选 B 。
一种化学 “ 自充电 ” 的锌 - 有机物电池,电解质为 和
水溶液。将电池暴露于空气中,某电极无需外接电源即能实现化学自充电,该电极充放电原理如下图所示。下列说法正确的是
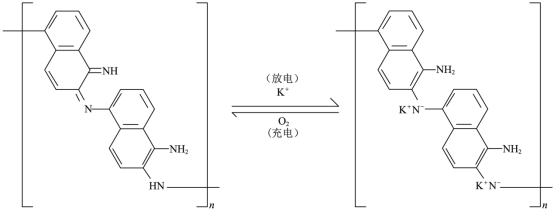
A .化学自充电时, 增大
B .化学自充电时,电能转化为化学能
C .化学自充电时,锌电极反应式:
D .放电时,外电路通过 电子,正极材料损耗
A
【详解】 A .由图可知,化学自充电时,消耗 O 2 ,该反应为 O 2 +2H 2 O+4e - =4OH - , 增大,故 A 正确;
B .化学自充电时,无需外接电源即能实现化学自充电,该过程不是电能转化为化学能,故 B 错误;
C .由图可知,化学自充电时,锌电极作阴极,该电极的电极反应式为 O 2 +2H 2 O+4e - =4OH - ,故 C 错误;
D .放电时, 1mol  转化为
转化为  ,消耗 2mol K + ,外电路通过
,消耗 2mol K + ,外电路通过 电子时,正极物质增加 0.02mol K + ,增加的质量为 0.02mol×39g/mol =0.78g ,故 D 错误;
故选 A 。
稀土 ( ) 包括镧、钇等元素,是高科技发展的关键支撑。我国南方特有的稀土矿可用离子交换法处理,一种从该类矿 ( 含铁、铝等元素 ) 中提取稀土的工艺如下:

已知:月桂酸 熔点为
;月桂酸和
均难溶于水。该工艺条件下,稀土离子保持
价不变;
的
,
开始溶解时的 pH 为 8.8 ;有关金属离子沉淀的相关 pH 见下表。
| 离子 | | | | |
| 开始沉淀时的 pH | 8.8 | 1.5 | 3.6 | 6.2~7.4 |
| 沉淀完全时的 pH | / | 3.2 | 4.7 | / |
(1)“ 氧化调 pH” 中,化合价有变化的金属离子是 。
(2)“ 过滤 1” 前,用 溶液调 pH 至 的范围内,该过程中
发生反应的离子方程式为 。
(3)“ 过滤 2” 后,滤饼中检测不到 元素,滤液 2 中
浓度为
。为尽可能多地提取
,可提高月桂酸钠的加入量,但应确保 “ 过滤 2” 前的溶液中
低于
( 保留两位有效数字 ) 。
(4)①“ 加热搅拌 ” 有利于加快 溶出、提高产率,其原因是 。
②“ 操作 X” 的过程为:先 ,再固液分离。
(5) 该工艺中,可再生循环利用的物质有 ( 写化学式 ) 。
(6) 稀土元素钇 (Y) 可用于制备高活性的合金类催化剂 。
① 还原 和
熔融盐制备
时,生成 1mol
转移
电子。
② 用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化
的还原,发生的电极反应为 。
(1)Fe 2+
(2) 4.7 pH<6.2
(3)4.0 10 -4
(4) 加热搅拌可加快反应速率 冷却结晶
(5)MgSO 4
(6) 15 O 2 +4e - +2H 2 O=4OH -
【分析】由流程可知,该类矿 ( 含铁、铝等元素 ) 加入酸化 MgSO 4 溶液浸取,得到浸取液中含有 、
、
、
、
、
等离子,经氧化调 pH 使
、
形成沉淀,经过滤除去,滤液 1 中含有
、
、
等离子,加入月桂酸钠,使
形成
沉淀,滤液 2 主要含有 MgSO 4 溶液,可循环利用,滤饼加盐酸,经加热搅拌溶解后,再冷却结晶,析出月桂酸,再固液分离得到 RECl 3 溶液。
【详解】( 1 )由分析可知, “ 氧化调 pH” 目的是除去含铁、铝等元素的离子,需要将 Fe 2+ 氧化为 Fe 3+ ,以便后续除杂,所以化合价有变化的金属离子是 Fe 2+ ,故答案为: Fe 2+ ;
( 2 )由表中数据可知, 沉淀完全的 pH 为 4.7 ,而
开始沉淀的 pH 为 6.2~7.4 ,所以为保证
、
沉淀完全,且
不沉淀,要用
溶液调 pH 至 4.7
pH<6.2 的范围内,该过程中
发生反应的离子方程式为
,故答案为: 4.7
pH<6.2 ;
;
( 3 )滤液 2 中 浓度为
,即 0.1125mol/L ,根据
,若要加入月桂酸钠后只生成
,而不产生
,则
=
=4.0
10 -4
,故答案为: 4.0
10 -4 ;
( 4 ) ①“ 加热搅拌 ” 有利于加快 溶出、提高产率,其原因是加热搅拌可加快反应速率,故答案为:加热搅拌可加快反应速率;
② “ 操作 X” 的结果是分离出月桂酸,由信息可知,月桂酸 熔点为
,故 “ 操作 X” 的过程为:先冷却结晶,再固液分离,故答案为:冷却结晶;
( 5 )由分析可知,该工艺中,可再生循环利用的物质有 MgSO 4 ,故答案为: MgSO 4 ;
( 6 ) ① 中 Y 为 +3 价,
中 Pt 为 +4 价,而
中金属均为 0 价,所以还原
和
熔融盐制备
时,生成 1mol
转移 15
电子,故答案为: 15 ;
② 碱性溶液中,氢氧燃料电池正极发生还原反应,发生的电极反应为 O 2 +4e - +2H 2 O=4OH ,故答案为: O 2 +4e - +2H 2 O=4OH - 。
下列关于 的化合物之间转化反应的离子方程式书写正确的是
A .碱转化为酸式盐:
B .碱转化为两种盐:
C .过氧化物转化为碱:
D .盐转化为另一种盐:
B
【详解】 A .向氢氧化钠溶液中通入足量的二氧化碳,碱可以转化成酸式盐,离子方程式为: CO 2 +OH - = ,故 A 错误;
B .氯气通入 NaOH 溶液中可以生成氯化钠和次氯酸钠两种盐,其离子方程式为: Cl 2 +2OH - =Cl - +ClO - +H 2 O ,故 B 正确;
C .钠的过氧化物为 Na 2 O 2 ,可以和水反应生成氢氧化钠,但在离子方程式里 Na 2 O 2 不能拆成离子,故 C 错误;
D .硅酸钠溶于水,在离子方程式里要写成离子,故 D 错误;
故选 B 。
铬及其化合物在催化、金属防腐等方面具有重要应用。
(1) 催化剂 可由
加热分解制备,反应同时生成无污染气体。
① 完成化学方程式:
。
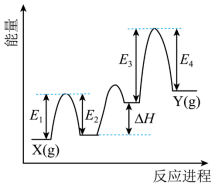
② 催化丙烷脱氢过程中,部分反应历程如图,
过程的焓变为 ( 列式表示 ) 。
③ 可用于
的催化氧化。设计从
出发经过 3 步反应制备
的路线 ( 用 “→” 表示含氮物质间的转化 ) ;其中一个有颜色变化的反应的化学方程式为 。
(2) 溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
(ⅰ)
(ⅱ)
① 下列有关 溶液的说法正确的有 。
A .加入少量硫酸,溶液的 pH 不变
B .加入少量水稀释,溶液中离子总数增加
C .加入少量 溶液,反应 (ⅰ) 的平衡逆向移动
D .加入少量 固体,平衡时
与
的比值保持不变
②25℃ 时, 溶液中
随 pH 的变化关系如图。当
时,设
、
与
的平衡浓度分别为 x 、 y 、
,则 x 、 y 、 z 之间的关系式为
;计算溶液中
的平衡浓度 ( 写出计算过程,结果保留两位有效数字 ) 。
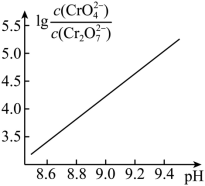
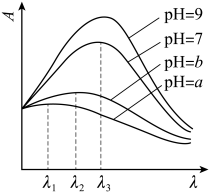
③ 在稀溶液中,一种物质对光的吸收程度 (A) 与其所吸收光的波长 ( ) 有关;在一定波长范围内,最大 A 对应的波长 (
) 取决于物质的结构特征;浓度越高, A 越大。混合溶液在某一波长的 A 是各组分吸收程度之和。为研究对反应 (ⅰ) 和 (ⅱ) 平衡的影响,配制浓度相同、
不同的
稀溶液,测得其 A 随
的变化曲线如图,波长
、
和
中,与
的
最接近的是 ;溶液
从 a 变到 b 的过程中,
的值 ( 填 “ 增大 ”“ 减小 ” 或 “ 不变 ”) 。
(1) N 2 ↑ 4H 2 O ( E 1 - E 2 )+Δ H +( E 3 - E 4 ) 2NO+O 2 =2NO 2
(2) BD 当溶液 pH=9 时,
,因此可忽略溶液中
即 =0.20
反应 (ii) 的平衡常数 K 2 = =
=3.3×10 -7
联立两个方程可得 =6.0×10 -4 mol/L λ 3 增大
【详解】( 1 ) ① 分解过程中,生成 Cr 2 O 3 和无污染气体,根据元素守恒可知,其余生成物为 N 2 、 H 2 O ,根据原子守恒可知反应方程式为
,故答案为: N 2 ↑ ; 4H 2 O 。
② 设反应过程中第一步的产物为 M ,第二步的产物为 N ,则 X→M Δ H 1 =( E 1 - E 2 ) , M→N Δ H 2 =Δ H , N→Y Δ H 3 =( E 3 - E 4 ) 1 ,根据盖斯定律可知, X(g)→Y(g) 的焓变为 Δ H 1 +Δ H 2 +Δ H 3 =( E 1 - E 2 )+Δ H +( E 3 - E 4 ) ,故答案为: ( E 1 - E 2 )+Δ H +( E 3 - E 4 ) 。
③NH 3 在 Cr 2 O 3 作催化剂条件下,能与 O 2 反应生成 NO , NO 与 O 2 反应生成红棕色气体 NO 2 , NO 2 与 H 2 O 反应生成 HNO 3 和 NO ,若同时通入 O 2 ,可将氮元素全部氧化为 HNO 3 ,因此从 NH 3 出发经过 3 步反应制备 HNO 3 的路线为 ;其中 NO 反应生成 NO 2 过程中,气体颜色发生变化,其反应方程式为 2NO+O 2 =2NO 2 ,故答案为:
; 2NO+O 2 =2NO 2 。
( 2 ) ①K 2 Cr 2 O 7 溶液中存在平衡: (i) 、 (ii)
。
A .向溶液中加入少量硫酸,溶液中 c (H + ) 增大, (ii) 平衡逆向移动,根据勒夏特列原理可知,平衡移动只是减弱改变量,平衡后,溶液中 c (H + ) 依然增大,因此溶液的 pH 将减小,故 A 错误;
B .加水稀释过程中,根据 “ 越稀越水解 ” 、 “ 越稀越电离 ” 可知, (i) 和 (ii) 的平衡都正向移动,两个平衡正向都是离子数增大的反应,因此稀释后,溶液中离子总数将增大,故 B 正确;
C .加入少量 NaOH 溶液, (ii) 正向移动,溶液中 将减小, (i) 将正向移动,故 C 错误;
D .平衡 (i) 的平衡常数 K 1 = ,平衡常数只与温度和反应本身有关,因此加入少量 K 2 Cr 2 O 7 溶液,
不变,故 D 正确;
综上所述,答案为: BD 。
②0.10mol/L K 2 Cr 2 O 7 溶液中, Cr 原子的总浓度为 0.20mol/L ,当溶液 pH=9.00 时,溶液中 Cr 原子总浓度为 =0.20mol/L ,
、
与
的平衡浓度分别为 x 、 y 、 z mol/L ,因此
=0.10 ;由图 8 可知,当溶液 pH=9 时,
,因此可忽略溶液中
,即
=0.20 ,反应 (ii) 的平衡常数 K 2 =
=
=3.3×10 -7 ,联立两个方程可得
=6.0×10 -4 mol/L 。
③ 根据反应 (i) 、 (ii) 是离子浓度增大的平衡可知,溶液 pH 越大,溶液中 越大,混合溶液在某一波长的 A 越大,溶液的 pH 越大,溶液中
越大,因此与
的 λ max 最接近的是 λ 3 ;反应 (i) 的平衡常数 K 1 =
,反应 (ii) 的平衡常数 K 2 =
,
=
=
,因此
=
,由上述分析逆推可知, b>a ,即溶液 pH 从 a 变到 b 的过程中,溶液中 c (H + ) 减小,所以
的值将增大,故答案为: λ 3 ;增大。
科学家基于 易溶于
的性质,发展了一种无需离子交换膜的新型氯流电池,可作储能设备 ( 如图 ) 。充电时电极 a 的反应为:
。下列说法正确的是
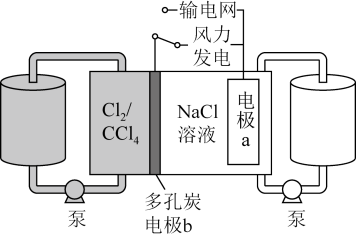
A .充电时电极 b 是阴极
B .放电时 溶液的
减小
C .放电时 溶液的浓度增大
D .每生成 ,电极 a 质量理论上增加
C
【详解】 A .由充电时电极 a 的反应可知,充电时电极 a 发生还原反应,所以电极 a 是阴极,则电极 b 是阳极,故 A 错误;
B .放电时电极反应和充电时相反,则由放电时电极 a 的反应为 可知, NaCl 溶液的 pH 不变,故 B 错误;
C .放电时负极反应为 ,正极反应为
,反应后 Na + 和 Cl - 浓度都增大,则放电时 NaCl 溶液的浓度增大,故 C 正确;
D .充电时阳极反应为 ,阴极反应为
,由得失电子守恒可知,每生成 1molCl 2 ,电极 a 质量理论上增加 23g/mol
2mol=46g ,故 D 错误;
答案选 C 。
在相同条件下研究催化剂 I 、 Ⅱ 对反应 的影响,各物质浓度 c 随反应时间 t 的部分变化曲线如图,则
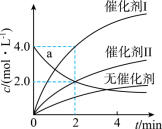
A .无催化剂时,反应不能进行
B .与催化剂 Ⅰ 相比, Ⅱ 使反应活化能更低
C . a 曲线表示使用催化剂 Ⅱ 时 X 的浓度随 t 的变化
D .使用催化剂 Ⅰ 时, 内,
D
【详解】 A .由图可知,无催化剂时,随反应进行,生成物浓度也在增加,说明反应也在进行,故 A 错误;
B .由图可知,催化剂 I 比催化剂 Ⅱ 催化效果好,说明催化剂 I 使反应活化能更低,反应更快,故 B 错误;
C .由图可知,使用催化剂 Ⅱ 时,在 0~2min 内 Y 的浓度变化了 2.0mol/L ,而 a 曲线表示的 X 的浓度变化了 2.0mol/L ,二者变化量之比不等于化学计量数之比,所以 a 曲线不表示使用催化剂 Ⅱ 时 X 浓度随时间 t 的变化,故 C 错误;
D .使用催化剂 I 时,在 0~2min 内, Y 的浓度变化了 4.0mol/L ,则 (Y) =
=
=2.0
,
(X) =
(Y) =
2.0
=1.0
,故 D 正确;
答案选 D 。
查看答案
单次付费有效 3.99 元
用于查看答案,单次有效 19.99元
包月VIP 9.99 元
用于查看答案,包月VIP无限次 49.99元