铬及其化合物在催化、金属防腐等方面具有重要应用。
(1) 催化剂 可由
加热分解制备,反应同时生成无污染气体。
① 完成化学方程式:
。
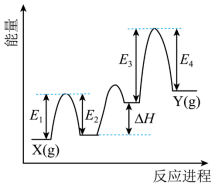
② 催化丙烷脱氢过程中,部分反应历程如图,
过程的焓变为 ( 列式表示 ) 。
③ 可用于
的催化氧化。设计从
出发经过 3 步反应制备
的路线 ( 用 “→” 表示含氮物质间的转化 ) ;其中一个有颜色变化的反应的化学方程式为 。
(2) 溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
(ⅰ)
(ⅱ)
① 下列有关 溶液的说法正确的有 。
A .加入少量硫酸,溶液的 pH 不变
B .加入少量水稀释,溶液中离子总数增加
C .加入少量 溶液,反应 (ⅰ) 的平衡逆向移动
D .加入少量 固体,平衡时
与
的比值保持不变
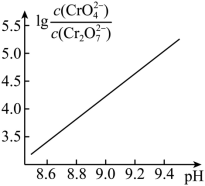
②25℃ 时, 溶液中
随 pH 的变化关系如图。当
时,设
、
与
的平衡浓度分别为 x 、 y 、
,则 x 、 y 、 z 之间的关系式为
;计算溶液中
的平衡浓度 ( 写出计算过程,结果保留两位有效数字 ) 。
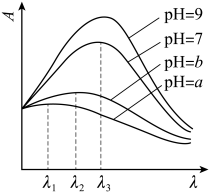
③ 在稀溶液中,一种物质对光的吸收程度 (A) 与其所吸收光的波长 ( ) 有关;在一定波长范围内,最大 A 对应的波长 (
) 取决于物质的结构特征;浓度越高, A 越大。混合溶液在某一波长的 A 是各组分吸收程度之和。为研究对反应 (ⅰ) 和 (ⅱ) 平衡的影响,配制浓度相同、
不同的
稀溶液,测得其 A 随
的变化曲线如图,波长
、
和
中,与
的
最接近的是 ;溶液
从 a 变到 b 的过程中,
的值 ( 填 “ 增大 ”“ 减小 ” 或 “ 不变 ”) 。
答案
(1) N 2 ↑ 4H 2 O ( E 1 - E 2 )+Δ H +( E 3 - E 4 ) 2NO+O 2 =2NO 2
(2) BD 当溶液 pH=9 时,
,因此可忽略溶液中
即 =0.20
反应 (ii) 的平衡常数 K 2 = =
=3.3×10 -7
联立两个方程可得 =6.0×10 -4 mol/L λ 3 增大
【详解】( 1 ) ① 分解过程中,生成 Cr 2 O 3 和无污染气体,根据元素守恒可知,其余生成物为 N 2 、 H 2 O ,根据原子守恒可知反应方程式为
,故答案为: N 2 ↑ ; 4H 2 O 。
② 设反应过程中第一步的产物为 M ,第二步的产物为 N ,则 X→M Δ H 1 =( E 1 - E 2 ) , M→N Δ H 2 =Δ H , N→Y Δ H 3 =( E 3 - E 4 ) 1 ,根据盖斯定律可知, X(g)→Y(g) 的焓变为 Δ H 1 +Δ H 2 +Δ H 3 =( E 1 - E 2 )+Δ H +( E 3 - E 4 ) ,故答案为: ( E 1 - E 2 )+Δ H +( E 3 - E 4 ) 。
③NH 3 在 Cr 2 O 3 作催化剂条件下,能与 O 2 反应生成 NO , NO 与 O 2 反应生成红棕色气体 NO 2 , NO 2 与 H 2 O 反应生成 HNO 3 和 NO ,若同时通入 O 2 ,可将氮元素全部氧化为 HNO 3 ,因此从 NH 3 出发经过 3 步反应制备 HNO 3 的路线为 ;其中 NO 反应生成 NO 2 过程中,气体颜色发生变化,其反应方程式为 2NO+O 2 =2NO 2 ,故答案为:
; 2NO+O 2 =2NO 2 。
( 2 ) ①K 2 Cr 2 O 7 溶液中存在平衡: (i) 、 (ii)
。
A .向溶液中加入少量硫酸,溶液中 c (H + ) 增大, (ii) 平衡逆向移动,根据勒夏特列原理可知,平衡移动只是减弱改变量,平衡后,溶液中 c (H + ) 依然增大,因此溶液的 pH 将减小,故 A 错误;
B .加水稀释过程中,根据 “ 越稀越水解 ” 、 “ 越稀越电离 ” 可知, (i) 和 (ii) 的平衡都正向移动,两个平衡正向都是离子数增大的反应,因此稀释后,溶液中离子总数将增大,故 B 正确;
C .加入少量 NaOH 溶液, (ii) 正向移动,溶液中 将减小, (i) 将正向移动,故 C 错误;
D .平衡 (i) 的平衡常数 K 1 = ,平衡常数只与温度和反应本身有关,因此加入少量 K 2 Cr 2 O 7 溶液,
不变,故 D 正确;
综上所述,答案为: BD 。
②0.10mol/L K 2 Cr 2 O 7 溶液中, Cr 原子的总浓度为 0.20mol/L ,当溶液 pH=9.00 时,溶液中 Cr 原子总浓度为 =0.20mol/L ,
、
与
的平衡浓度分别为 x 、 y 、 z mol/L ,因此
=0.10 ;由图 8 可知,当溶液 pH=9 时,
,因此可忽略溶液中
,即
=0.20 ,反应 (ii) 的平衡常数 K 2 =
=
=3.3×10 -7 ,联立两个方程可得
=6.0×10 -4 mol/L 。
③ 根据反应 (i) 、 (ii) 是离子浓度增大的平衡可知,溶液 pH 越大,溶液中 越大,混合溶液在某一波长的 A 越大,溶液的 pH 越大,溶液中
越大,因此与
的 λ max 最接近的是 λ 3 ;反应 (i) 的平衡常数 K 1 =
,反应 (ii) 的平衡常数 K 2 =
,
=
=
,因此
=
,由上述分析逆推可知, b>a ,即溶液 pH 从 a 变到 b 的过程中,溶液中 c (H + ) 减小,所以
的值将增大,故答案为: λ 3 ;增大。




