异丙醇 可由生物质转化得到,催化异丙醇脱水制取高值化学品丙烯
的工业化技术已引起人们的关注,其主要反应如下:
Ⅰ.
Ⅱ.
回答下列问题:
(1) 已知 ,则
燃烧生成
和
的热化学方程式为 。
(2) 在 下,刚性密闭容器中的反应体系内水蒸气浓度与反应时间关系如下表:
| 反应时间 | 0 | 4 | 8 | 12 | t | 20 |
| | 0 | 2440 | 3200 | 3600 | 4000 | 4100 |
① 内,
;
②t 16( 填 “>”“<” 或 “=”) 。
(3) 在恒温刚性密闭容器中,反应 Ⅰ 、 Ⅱ 均达到平衡的判据是 ( 填标号 ) 。
a. 的分压不变 b. 混合气体密度不变
c. d.
(4) 在一定条件下,若反应 Ⅰ 、 Ⅱ 的转化率分别为 98% 和 40% ,则丙烯的产率为 。
(5) 下图为反应 Ⅰ 、 Ⅱ 达到平衡时 与温度的关系曲线。
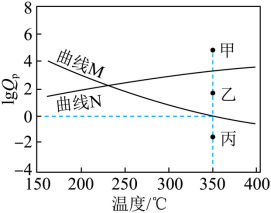
( 已知:对于可逆反应 ,任意时刻
,式中
) 表示物质 × 的分压 )
① 在 恒压平衡体系中充入少量水蒸气时,反应 Ⅰ 的的状态最有可能对应图中的 点 ( 填 “ 甲 ”“ 乙 ” 或 “ 丙 ”) ,判断依据是 。
② 时,在密闭容器中加入一定量的
,体系达到平衡后,测得
的分压为
,则水蒸气的分压为
( 用含 x 的代数式表示 ) 。
答案
(1)
(2) 190 >
(3)ad
(4)58.8%
(5) 甲 反应 I 平衡曲线为 N ,恒压时充入水蒸气,
【详解】( 1 )设 Ⅲ ,根据盖斯定律 Ⅲ-2×Ⅰ 得
。
( 2 ) ① 内,
,则
;
② 、
、
, △ c (H 2 O) 逐渐减小,说明反应速率减小,
内, Δ c (H 2 O)=400ppm ,
内, Δ c (H 2 O)=400ppm ,则 t-12>4 ,即 t>16 。
( 3 ) a . H 2 O 的分压不变,则 C 3 H 6 的分压也不变,反应 1 、 Ⅱ 各组分分压不变,反应 1 、 Ⅱ 均达到平衡, a 正确;
b .反应物和生成物均为气体,混合气体的总质量不变,刚性密闭容器体积不变,则混合气体密度不变,不能作为反应 I 、 Ⅱ 均达到平衡的判据, b 错误;
c .当 时,反应不一定达到平衡,不能作为反应 1 、 Ⅱ 均达到平衡的判据, c 错误;
d . ,说明正逆反应速率相等,反应 I 达平衡,各组分分压不变, C 3 H 6 的分压不变,说明反应 Ⅱ 也达平衡, d 正确;
故选 ad 。
( 4 )设 C 3 H 8 O 的物质的量为 1mol ,若 lmol C 3 H 8 O 完全反应,理论上生成 1mol C 3 H 6 ,因为反应 Ⅰ 、 Ⅱ 的转化率分别为 98% 和 40% ,反应 I 生成 1mol×98%=0.98mol C 3 H 6 ,反应 Ⅱ 消耗了 40% C 3 H 6 ,则达平衡时 C 3 H 6 的物质的量为 0.98mol×(1-40%)=0.588mol ,所以丙烯的产率为 =58.8% 。
( 5 ) ① 反应 I 为气体体积增大的吸热反应,反应 Ⅱ 为气体体积减小的放热反应,则升高温度,反应 I 正向移动, 逐渐增大,反应 Ⅱ 逆向移动,
逐渐减小,即反应 I 为平衡曲线为 N ,反应 Ⅱ 平衡曲线为 M ;在 350℃ 恒压平衡体系中充入少量水蒸气时,对于反应 I 而言,相当于增大生成物浓度,使得
>
,即 lg
增大,反应 I 的状态最有可能对应图中的甲;
② 由图可知, 350°C 时达平衡后, =0 ,则 350℃ 时
=
=1 ,设水蒸气的平衡分压为 a MPa ,则反应 II 的 C 3 H 6 起始分压为 a MPa ,对反应 Ⅱ 列三段式有
,解得 a=
MPa 。

 pC(g)+qD(g)
pC(g)+qD(g)  。
。 时,平衡便会发生移动而使各组分的浓度、百分含量发生变化,直至建立新的平衡。
时,平衡便会发生移动而使各组分的浓度、百分含量发生变化,直至建立新的平衡。 指的是同一物质的正反应速率与逆反应速率相等。
指的是同一物质的正反应速率与逆反应速率相等。  qD(g),根据对化学平衡概念的理解,判断下列各情况是否达到平衡。
qD(g),根据对化学平衡概念的理解,判断下列各情况是否达到平衡。