恒温恒容条件下,向密闭容器中加入一定量 X ,发生反应的方程式为 ① ; ②
。反应 ① 的速率
,反应 ② 的速率
,式中
为速率常数。图甲为该体系中 X 、 Y 、 Z 浓度随时间变化的曲线,图乙为反应 ① 和 ② 的
曲线。下列说法错误的是
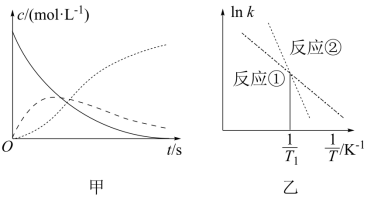
A .随 的减小,反应 ① 、 ② 的速率均降低
B .体系中
C .欲提高 Y 的产率,需提高反应温度且控制反应时间
D .温度低于 时,总反应速率由反应 ② 决定
答案
AB
【分析】由图中的信息可知,浓度随时间变化逐渐减小的代表的是 X ,浓度随时间变化逐渐增大的代表的是 Z ,浓度随时间变化先增大后减小的代表的是 Y ;由图乙中的信息可知,反应 ① 的速率常数随温度升高增大的幅度小于反应 ② 的。
【详解】 A .由图甲中的信息可知,随 c(X) 的减小, c(Y) 先增大后减小, c(Z) 增大,因此,反应 ① 的速率随 c(X) 的减小而减小,而反应 ② 的速率先增大后减小, A 说法错误;
B .根据体系中发生的反应可知,在 Y 的浓度达到最大值之前,单位时间内 X 的减少量等于 Y 和 Z 的增加量,因此, v (X)= v (Y) + v (Z) ,但是,在 Y 的浓度达到最大值之后,单位时间内 Z 的增加量等于 Y 和 X 的减少量,故 v (X) + v (Y) = v (Z) , B 说法错误;
C .升高温度可以可以加快反应 ① 的速率,但是反应 ① 的速率常数随温度升高增大的幅度小于反应 ② 的,且反应 ② 的的速率随着 Y 的浓度的增大而增大,因此,欲提高 Y 的产率,需提高反应温度且控制反应时间, C 说法正确;
D .由图乙信息可知,温度低于 T 1 时, k 1 > k 2 ,反应 ② 为慢反应,因此,总反应速率由反应 ② 决定, D 说法正确;
综上所述,本题选 AB 。