用0.100 mol·L-1 AgNO3滴定50.0 mL 0.0500 mol·L-1 Cl-溶液的滴定曲线如图所示。下列有关描述错误的是( )
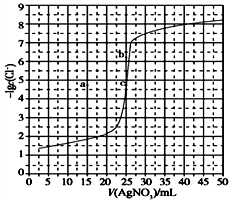
A.根据曲线数据计算可知Ksp(AgCl)的数量级为10-10
B.曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=Ksp(AgCl)
C.相同实验条件下,若改为0.0400 mol·L-1 Cl-,反应终点c移到a
D.相同实验条件下,若改为0.0500 mol·L-1 Br-,反应终点c向b方向移动
C
【分析】
本题应该从题目所给的图入手,寻找特定数据判断题目中的沉淀滴定的具体过程。注意:横坐标是加入的硝酸银溶液的体积,纵坐标是氯离子浓度的负对数。
【详解】
A.选取横坐标为50mL的点,此时向50mL 0.05mol/L的Cl-溶液中,加入了50mL 0.1mol/L的AgNO3溶液,所以计算出此时溶液中过量的Ag+浓度为0.025mol/L(按照银离子和氯离子1:1沉淀,同时不要忘记溶液体积变为原来2倍),由图示得到此时Cl-约为1×10-8mol/L(实际稍小),所以KSP(AgCl)约为0.025×10-8=2.5×10-10,所以其数量级为10-10,选项A正确;
B.由于KSP(AgCl)极小,所以向溶液滴加硝酸银就会有沉淀析出,溶液一直是氯化银的饱和溶液,所以c(Ag+)·c(Cl-)=KSP(AgCl),选项B正确;
C.滴定的过程是用硝酸银滴定氯离子,所以滴定的终点应该由原溶液中氯离子的物质的量决定,将50mL 0.05mol/L的Cl-溶液改为50mL 0.04mol/L的Cl-溶液,此时溶液中的氯离子的物质的量是原来的0.8倍,所以滴定终点需要加入的硝酸银的量也是原来的0.8倍,因此应该由c点的25mL变为25×0.8=20mL,而a点对应的是15mL,选项C错误;
D.卤化银从氟化银到碘化银的溶解度应该逐渐减小,所以KSP(AgCl)应该大于KSP(AgBr),将50mL 0.05mol/L的Cl-溶液改为50mL 0.05mol/L的Br-溶液,这是将溶液中的氯离子换为等物质的量的溴离子,因为银离子和氯离子或溴离子都是1:1沉淀的,所以滴定终点的横坐标不变,但是因为溴化银更难溶,所以终点时,溴离子的浓度应该比终点时氯离子的浓度更小,所以有可能由a点变为b点。选项D正确;
故答案选C。
【点睛】
本题虽然选择了一个学生不太熟悉的滴定过程——沉淀滴定,但是其内在原理实际和酸碱中和滴定是一样的。这种滴定的理论终点都应该是恰好反应的点,酸碱中和滴定是酸碱恰好中和,沉淀滴定就是恰好沉淀,这样就能判断溶液发生改变的时候,滴定终点如何变化了。
根据下列图示所得出的结论不正确的是
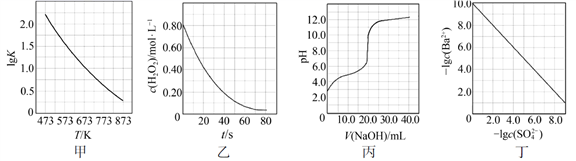
A.图甲是CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
B.图乙是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小
C.图丙是室温下用0.1000 mol·L−1NaOH溶液滴定20.00 mL 0.1000 mol·L−1某一元酸HX的滴定曲线,说明HX是一元强酸
D.图丁是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+ )与c(SO42−)的关系曲线,说明溶液中c(SO42− )越大c(Ba2+ )越小
C
【解析】
A. 升高温度,lgK减小,平衡向逆反应方向移动,逆反应为吸热反应,正反应为放热反应,该反应的ΔH![]() 0;
0;
B. 根据图像,随着时间的推移,c(H2O2)变化趋于平缓,随着反应的进行H2O2分解速率逐渐减小;
C. 根据图像,没有滴入NaOH溶液时,0.1000mol/LHX溶液的pH![]() 1,HX为一元弱酸;
1,HX为一元弱酸;
D. 根据图像可见横坐标越小,纵坐标越大,-lgc(SO42-)越小,-lgc(Ba2+)越大,说明c(SO42-)越大c(Ba2+)越小。
【详解】
A. 升高温度,lgK减小,平衡向逆反应方向移动,逆反应为吸热反应,正反应为放热反应,该反应的ΔH![]() 0,A项正确;
0,A项正确;
B. 根据图像,随着时间的推移,c(H2O2)变化趋于平缓,随着反应的进行H2O2分解速率逐渐减小,B项正确;
C. 根据图像,没有滴入NaOH溶液时,0.1000mol/LHX溶液的pH![]() 1,HX为一元弱酸,C项错误;
1,HX为一元弱酸,C项错误;
D. 根据图像可见横坐标越小,纵坐标越大,-lgc(SO42-)越小,-lgc(Ba2+)越大,说明c(SO42-)越大c(Ba2+)越小,D项正确;
答案选C。
【点睛】
本题考查图像的分析,侧重考查温度对化学平衡常数的影响、化学反应速率、酸碱中和滴定pH曲线的分析、沉淀溶解平衡曲线的分析,掌握有关的原理,明确图像中纵、横坐标的含义和曲线的变化趋势是解题的关键。
下列实验误差分析不正确的是( )
A.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
B.滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
C.用润湿的pH试纸测稀碱溶液的pH,测定值偏小
D.测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度差值△t偏小
A
【解析】
分析:A项,用容量瓶配制溶液,定容时俯视刻度线,所配溶液体积偏小,所配溶液浓度偏大;B项,滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小;C项,用湿润pH试纸测稀碱液的pH,c(OH-)偏小,pH测定值偏小;D项,测定中和热时,将碱缓慢倒入酸中,散失热量较多,所测温度值偏小。
详解:A项,用容量瓶配制溶液,定容时俯视刻度线,所配溶液体积偏小,根据公式cB=![]() ,所配溶液浓度偏大,A项错误;B项,滴定前滴定管内无气泡,终点读数时有气泡,终点读数偏小,所测体积偏小,B项正确;C项,用湿润pH试纸测稀碱液的pH,c(OH-)偏小,pH测定值偏小,C项正确;D项,测定中和热时,将碱缓慢倒入酸中,散失热量较多,所测温度值偏小,D项正确;答案选A。
,所配溶液浓度偏大,A项错误;B项,滴定前滴定管内无气泡,终点读数时有气泡,终点读数偏小,所测体积偏小,B项正确;C项,用湿润pH试纸测稀碱液的pH,c(OH-)偏小,pH测定值偏小,C项正确;D项,测定中和热时,将碱缓慢倒入酸中,散失热量较多,所测温度值偏小,D项正确;答案选A。
下列图示与对应的叙述相符的是( )
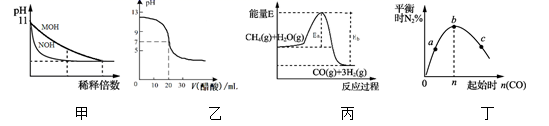
A.图甲表示常温下稀释pH均为11的MOH溶液和NOH溶液时pH的变化,由图可知溶液的碱性:MOH>NOH
B.图乙表示常温下0.100 0 mol·L-1醋酸溶液滴定20.00 mL0.100 0 mol·L-1 NaOH溶液的滴定曲线
C.图丙表示反应CH4(g)+H2O (g)![]() CO(g)+3H 2(g)的能量变化,使用催化剂可改变Eb﹣Ea的值
CO(g)+3H 2(g)的能量变化,使用催化剂可改变Eb﹣Ea的值
D.图丁表示反应2CO(g)+2NO(g)![]() N2(g)+2CO2(g),在其他条件不变时,改变起始CO的物质的量,平衡时N2的体积分数变化,由图可知NO的转化率c>b>a
N2(g)+2CO2(g),在其他条件不变时,改变起始CO的物质的量,平衡时N2的体积分数变化,由图可知NO的转化率c>b>a
D
【解析】
分析:本题考查对图像的理解和分析能力,涉及强弱电解质的稀释,中和滴定,能量变化和化学平衡。
详解:A、因为稀释能促进弱碱的电离,所以稀释pH均为11的MOH溶液和NOH溶液时pH变化大的碱性强,所以碱性:MOH<NOH,A错误;
B. 常温下0.100 0 mol·L-1醋酸溶液滴定20.00 mL0.100 0 mol·L-1 NaOH溶液,当加入20.00mL醋酸时,二者恰好反应生成醋酸钠,水解显碱性,而不是中性,所以B错误;
C.反应中加入催化剂会降低活化能,但不影响反应热,即使用催化剂不改变Eb﹣Ea的值,C错误;
D、反应2CO(g)+2NO(g)![]() N2(g)+2CO2(g),在其他条件不变的情况下增大起始物CO的物质的量,使一氧化氮转化率增大,NO的转化率c>b>a,D正确;因此本题答案为D。
N2(g)+2CO2(g),在其他条件不变的情况下增大起始物CO的物质的量,使一氧化氮转化率增大,NO的转化率c>b>a,D正确;因此本题答案为D。
下列实验操作规范且能达到目的的是
| 目的 | 操作 | |
| A | 取20.00 mL盐酸 | 在50 mL酸式滴定管中装入盐酸,调整初始读数为30.00 mL后,将剩余盐酸放入锥形瓶 |
| B | 清洗碘升华实验所用试管 | 先用酒精清洗,再用水清洗 |
| C | 测定醋酸钠溶液pH | 用玻璃棒蘸取溶液,点在湿润的pH试纸上 |
| D | 配制浓度为0.010 mol·L-1的KMnO4溶液 | 称取KMnO4固体0.158 g,放入100 mL容量瓶中,加水溶解并稀释至刻度 |
A.A B.B C.C D.D
B
【详解】
A. 50 mL酸式滴定管的50.00 mL刻度下方没有刻度,但仍有盐酸,所以调整初始读数为30.00 mL后,放入锥形瓶中盐酸的体积大于20.00 mL,A项错误;
B. 碘易溶于酒精,清洗试管中附着的碘可以先用酒精清洗,再用水清洗,B项正确;
C. 醋酸钠溶液呈碱性,测定醋酸钠溶液的pH时,pH试纸不能预先湿润(湿润相当于将溶液稀释),否则测定的pH会偏小,C项错误;
D. 不能在容量瓶中直接配制溶液,D项错误。
故答案选B。
本卷还有95题,登录并加入会员即可免费使用哦~

该作品由: 用户胡卫雄分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。