1962 年首个稀有气体化合物 问世,目前已知的稀有气体化合物中,含氙 ( 54 Xe) 的最多,氪 ( 36 Kr) 次之,氩 ( 18 Ar) 化合物极少。
是
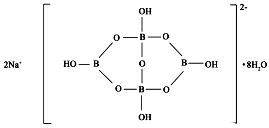
与
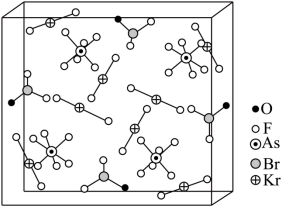
分子形成的加合物,其晶胞如下图所示。
回答下列问题:
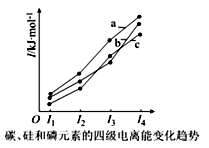
(1) 基态 原子的价电子排布式为 。
(2) 原子的活泼性依序增强,原因是 。
(3) 晶体熔点:
( 填 “>”“<” 或 “=”) ,判断依据是 。
(4) 的中心原子
的杂化轨道类型为 。
(5) 加合物中
,晶体中的微粒间作用力有 ( 填标号 ) 。
a. 氢键 b. 离子键 c. 极性共价键 d. 非极性共价键
答案
(1)
(2) 同族元素,从上而下原子半径逐渐增大,原子核对外层电子的有效吸引逐渐减弱,失电子能力逐渐增强
(3) < 二者为同构型的分子晶体, 相对分子质量大,范德华力大,熔点高
(4)
(5) 2 bc
【详解】( 1 ) 位于元素周期表中第四周期 VA 族,原子序数为 33 ,由构造原理写出其价电子排布式为
。
( 2 )同族元素,从上而下原子半径逐渐增大,原子核对外层电子的有效吸引逐渐减弱,失电子能力逐渐增强,故 原子的活泼性依序增强。
( 3 ) 和
是同构型的分子晶体,
相对分子质量大,范德华力大,熔点高,晶体熔点:
<
。
( 4 ) 的中心原子
的价层电子对数为: 3+
=4 ,杂化轨道类型为
。
( 5 )由晶胞结构可知,其中含有 8 个 、 4 个
、 4 个
,则
加合物中
2 ,晶体中的微粒间作用力有离子键、极性共价键,故选 bc 。