硒 ( ) 是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光 (
) 效应以来,
在发光材料、生物医学等领域引起广泛关注。一种含
的新型
分子
的合成路线如下:
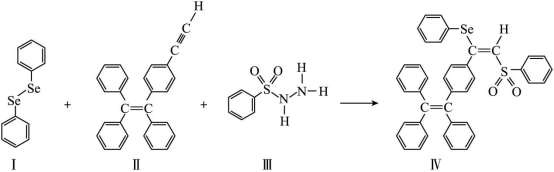
(1) 与 S 同族,基态硒原子价电子排布式为 。
(2) 的沸点低于
,其原因是 。
(3) 关于 I~III 三种反应物,下列说法正确的有 。
A . I 中仅有 键
B . I 中的 键为非极性共价键
C . II 易溶于水
D . II 中原子的杂化轨道类型只有 与
E . I~III 含有的元素中, O 电负性最大
(4)IV 中具有孤对电子的原子有 。
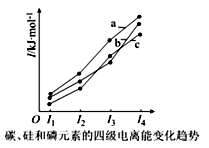
(5) 硒的两种含氧酸的酸性强弱为
( 填 “>” 或 “<”) 。研究发现,给小鼠喂食适量硒酸钠 (
) 可减轻重金属铊引起的中毒。
的立体构型为 。
(6) 我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物 X 是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图 1 ,沿 x 、 y 、 z 轴方向的投影均为图 2 。
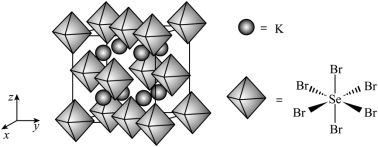
①X 的化学式为 。
② 设 X 的最简式的式量为 ,晶体密度为
,则 X 中相邻 K 之间的最短距离为
( 列出计算式,
为阿伏加德罗常数的值 ) 。
答案
(1)4s 2 4p 4
(2) 两者都是分子晶体,由于水存在分子间氢键,沸点高
(3)BDE
(4)O 、 Se
(5) > 正四面体形
(6) K 2 SeBr 6
【详解】( 1 )基态硫原子价电子排布式为 3s 2 3p 4 , 与 S 同族, Se 为第四周期元素,因此基态硒原子价电子排布式为 4s 2 4p 4 ;故答案为: 4s 2 4p 4 。
( 2 ) 的沸点低于
,其原因是两者都是分子晶体,由于水存在分子间氢键,沸点高;故答案为:两者都是分子晶体,由于水存在分子间氢键,沸点高。
( 3 ) A . I 中有 键,还有大 π 键,故 A 错误; B . Se−Se 是同种元素,因此 I 中的
键为非极性共价键,故 B 正确; C .烃都是难溶于水,因此 II 难溶于水,故 C 错误; D . II 中苯环上的碳原子和碳碳双键上的碳原子杂化类型为 sp 2 ,碳碳三键上的碳原子杂化类型为 sp ,故 D 正确; E .根据同周期从左到右电负性逐渐增大,同主族从上到下电负性逐渐减小,因此 I~III 含有的元素中, O 电负性最大,故 E 正确;综上所述,答案为: BDE 。
( 4 )根据题中信息 IV 中 O 、 Se 都有孤对电子,碳、氢、硫都没有孤对电子;故答案为: O 、 Se 。
( 5 )根据非羟基氧越多,酸性越强,因此硒的两种含氧酸的酸性强弱为 >
。
中 Se 价层电子对数为
,其立体构型为正四面体形;故答案为:>;正四面体形。
( 6 ) ① 根据晶胞结构得到 K 有 8 个,  有
有 ,则 X 的化学式为 K 2 SeBr 6 ;故答案为: K 2 SeBr 6 。
② 设 X 的最简式的式量为 ,晶体密度为
,设晶胞参数为 anm ,得到
,解得
, X 中相邻 K 之间的最短距离为晶胞参数的一半即
;故答案为:
。