铁和硒 ( ) 都是人体所必需的微量元素,且在医药、催化、材料等领域有广泛应用,回答下列问题:
(1) 乙烷硒啉 (Ethaselen) 是一种抗癌新药,其结构式如下:
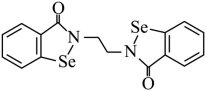
① 基态 原子的核外电子排布式为
;
② 该新药分子中有 种不同化学环境的 C 原子;
③ 比较键角大小:气态 分子
离子 ( 填 “>”“<” 或 “=”) ,原因是 。
(2) 富马酸亚铁 是一种补铁剂。富马酸分子的结构模型如图所示:
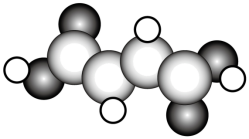
① 富马酸分子中 键与
键的数目比为 ;
② 富马酸亚铁中各元素的电负性由大到小的顺序为 。
(3) 科学家近期合成了一种固氮酶模型配合物,该物质可以在温和条件下直接活化 ,将
转化为
,反应过程如图所示:
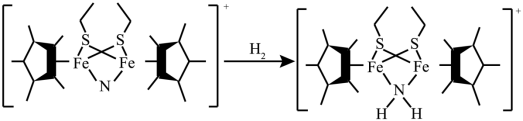
① 产物中 N 原子的杂化轨道类型为 ;
② 与 互为等电子体的一种分子为 ( 填化学式 ) 。
(4) 钾、铁、硒可以形成一种超导材料,其晶胞在 xz 、 yz 和 xy 平面投影分别如图所示:
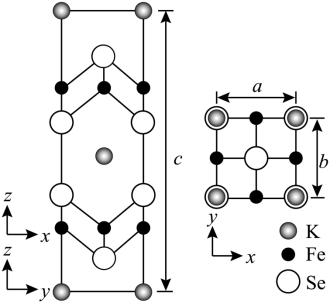
① 该超导材料的最简化学式为 ;
②Fe 原子的配位数为 ;
③ 该晶胞参数 、
。阿伏加德罗常数的值为
,则该晶体的密度为
( 列出计算式 ) 。
答案
(1) 3d 10 4s 2 4p 4 8
> SeO 3 的空间构型为平面三角形, SeO 的空间构型为三角锥形
(2) 11:3 O > C > H > Fe
(3) sp 3 杂化 H 2 O
(4) KFe 2 Se 2 4
【详解】( 1 ) ① 硒元素的原子序数为 34 ,基态原子的电子排布式为 [Ar] 3d 10 4s 2 4p 4 ,故答案为: 3d 10 4s 2 4p 4 ;
② 由结构简式可知,乙烷硒啉的分子结构对称,分子中含有 8 种化学环境不同的碳原子,故答案为: 8 ;
③ 三氧化硒分子中硒原子的价层电子对数为 3 ,孤对电子对数为 0 ,分子的空间构型为平面三角形,键角为 120° ,亚硒酸根离子中硒原子的价层电子对数为 4 ,孤对电子对数为 1 ,离子的空间构型为三角锥形,键角小于 120° ,故答案为:>; SeO 3 的空间构型为平面三角形, SeO 的空间构型为三角锥形;
( 2 ) ① 由球棍模型可知,富马酸的结构式为 HOOCCH=CHCOOH ,分子中的单键为 σ 键,双键中含有 1 个 σ 键和 1 个 π 键,则分子中 σ 键和 π 键的数目比为 11 : 3 ,故答案为: 11 : 3 ;
② 金属元素的电负性小于非金属元素,则铁元素的电负性最小,非金属元素的非金属性越强,电负性越大,氢碳氧的非金属性依次增强,则电负性依次增大,所以富马酸亚铁中四种元素的电负性由大到小的顺序为 O > C > H > Fe ,故答案为: O > C > H > Fe ;
( 3 ) ① 由结构简式可知,产物中氮原子的价层电子对数为 4 ,原子的杂化方式为 sp 3 杂化,故答案为: sp 3 杂化;
② 水分子和氨基阴离子的原子个数都为 3 、价电子数都为 8 ,互为等电子体,故答案为: H 2 O ;
( 4 ) ① 由平面投影图可知,晶胞中位于顶点和体心的钾原子个数为 8× +1=2 ,铁原子位于面心,原子个数为 8×
=4 ,位于棱上和体心的硒原子的个数为 8×
+2=4 ,则超导材料最简化学式为 KFe 2 Se 2 ,故答案为: KFe 2 Se 2 ;
② 由平面投影图可知,位于棱上的铁原子与位于面上的硒原子的距离最近,所以铁原子的配位数为 4 ,故答案为: 4 ;
③ 设晶体的密度为 dg/cm 3 ,由晶胞的质量公式可得: =abc×10 —21 ×d ,解得 d=
,故答案为:
。


 等。
等。  、金刚石等。
、金刚石等。  等。
等。  等。
等。  等。
等。  等。
等。  等。
等。  等原子晶体。
等原子晶体。  等)。
等)。