氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:
(1)H、B、N中,原子半径最大的是______。根据对角线规则,B的一些化学性质与元素______的相似。
(2)NH3BH3分子中,N—B化学键称为____键,其电子对由____提供。氨硼烷在催化剂作用下水解释放氢气:3NH3BH3+6H2O=3NH3+![]() +9H2,
+9H2,![]() 的结构如图所示:
的结构如图所示: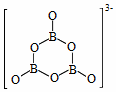 ;在该反应中,B原子的杂化轨道类型由______变为______。
;在该反应中,B原子的杂化轨道类型由______变为______。
(3)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),电负性大小顺序是__________。与NH3BH3原子总数相等的等电子体是_________(写分子式),其熔点比NH3BH3____________(填“高”或“低”),原因是在NH3BH3分子之间,存在____________________,也称“双氢键”。
(4)研究发现,氦硼烷在低温高压条件下为正交晶系结构,晶胞参数分别为a pm、b pm、c pm,α=β=γ=90°。氨硼烷的2×2×2超晶胞结构如图所示。

氨硼烷晶体的密度ρ=___________g·cm−3(列出计算式,设NA为阿伏加德罗常数的值)。
答案
B Si(硅) 配位 N sp3 sp2 N>H>B CH3CH3 低 Hδ+与Hδ−的静电引力 ![]()
【解析】
【分析】
根据元素在周期表中的位置比较和判断元素的相关性质;根据中心原子的价层电子对数确定其杂化轨道的类型;运用等量代换的方法寻找等电子体;根据电负性对化合价的影响比较不同元素的电负性;根据晶胞的质量和体积求晶体的密度。
【详解】
(1)在所有元素中,H原子的半径是最小的,同一周期从左到右,原子半径依次减小,所以,H、B、N中原子半径最大是B。B与Si在元素周期表中处于对角张的位置,根据对角线规则,B的一些化学性质与Si元素相似。
(2)B原子最外层有3个电子,其与3个H原子形成共价键后,其价层电子对只有3对,还有一个空轨道;在NH3中,N原子有一对孤对电子,故在NH3BH3分子中,N—B键为配位键,其电子对由N原子提供。NH3BH3分子中,B原子的价层电子对数为4,故其杂化方式为sp3。NH3BH3在催化剂的作用下水解生成氢气和B3O63-,由图中信息可知,B3O63-中每个B原子只形成3个σ键,其中的B原子的杂化方式为sp2,因此,B原子的杂化轨道类型由sp3变为sp2。
(3) NH3BH3分子中,与N原子相连的H呈正电性,说明N的电负性大于H;与B原子相连的H呈负电性,说明H的电负性大于B,因此3种元素电负性由大到小的顺序为N>H>B。NH3BH3分子中有8个原子,其价电子总数为14,N和B的价电子数的平均值为4,依据等量代换的原则,可以找到其等电子体为CH3CH3。由于NH3BH3分子属于极性分子,而CH3CH3属于非极性分子,两者相对分子质量接近,但是极性分子的分子间作用力较大,故CH3CH3熔点比NH3BH3低。NH3BH3分子间存在“双氢键”,类比氢键的形成原理,说明其分子间存在Hδ+与Hδ-的静电引力。
(4)在氨硼烷的2´2´2的超晶胞结构中,共有16个氨硼烷分子,晶胞的长、宽、高分别为2apm、2bpm、2cpm,若将其平均分为8份可以得到8个小长方体,则平均每个小长方体中占有2个氨硼烷分子,小长方体的长、宽、高分别为apm、bpm、cpm,则小长方体的质量为![]() ,小长方体的体积为
,小长方体的体积为![]() ,因此,氨硼烷晶体的密度为
,因此,氨硼烷晶体的密度为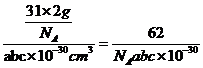 g∙cm-3。
g∙cm-3。
【点睛】
本题最后有关晶体密度的计算是难点,要求考生能读懂题意,通过观察晶胞结构,确定超晶胞结构中的分子数,并能合理分成8份,从而简化计算。


 等。
等。  、金刚石等。
、金刚石等。  等。
等。  等。
等。  等。
等。  等。
等。  等。
等。  等原子晶体。
等原子晶体。  等)。
等)。