炼锌工厂产生的含砷酸性污水需做无害化处理后排放,一种提取砷并将其资源化的工艺流程如下:
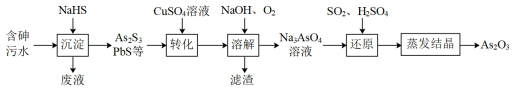
回答下列问题:
(1)“ 沉淀 ” 时,需控制溶液中 HS - 的浓度不能过高,原因为 _______ 。
(2)“ 转化 ” 时, As 2 S 3 在 CuSO 4 溶液中转化为 HAsO 2 ,该反应的化学方程式为 _______ 。
(3) 已知 K sp (PbS)=1×10 -26 、 K sp (PbSO 4 )=1×10 -8 , “ 溶解 ” 步骤中滤渣为 _______ 。 ( 填化学式 )
(4)“ 溶解 ” 时,发生反应的氧化剂和还原剂的物质的量之比为 _______ ,实验测得 Na 3 AsO 4 溶液呈碱性,其原因为 _______( 用离子方程式表示 ) 。
(5) 该流程制得 99g As 2 O 3 ,则 “ 还原 ” 时消耗标准状况下 SO 2 的体积为 _______ 。
答案
(1)HS - 的浓度过高,会与酸性废水中的 H + 反应产生有毒的 H 2 S 气体逸出
(2)As 2 S 3 +3CuSO 4 + 4H 2 O=2HAsO 2 +3CuS↓+3H 2 SO 4
(3)CuS 、 PbS
(4) 1 : 2 AsO + H 2 O ⇌ HAsO
+OH -
(5)22.4 L
【分析】含砷酸性污水加入硫氢化钠,将砷、铅转化为沉淀,沉淀加入硫酸铜溶液,将 As 2 S 3 在转化为 HAsO 2 和硫化铜,加入氢氧化钠、氧气将 HAsO 2 转化为 Na 3 AsO 4 溶液,加入二氧化硫、硫酸还原将五价砷转化为三价砷,蒸发结晶得到产品。
( 1 )
污水为含砷酸性污水,含有氢离子, “ 沉淀 ” 时,需控制溶液中 HS - 的浓度不能过高,原因为 HS - 的浓度过高,会与酸性废水中的 H + 反应产生有毒的 H 2 S 气体逸出,导致产生污染且原料利用率降低;
( 2 )
“ 转化 ” 时, As 2 S 3 在 CuSO 4 溶液中转化为 HAsO 2 ,则释放出硫离子与铜离子生成硫化铜沉淀,该反应的化学方程式为 As 2 S 3 +3CuSO 4 + 4H 2 O=2HAsO 2 +3CuS↓+3H 2 SO 4 ;
( 3 )
转化过程中得到 CuS 、 PbS 沉淀;已知 K sp (PbS)=1×10 -26 、 K sp (PbSO 4 )=1×10 -8 ,可知硫化铅更难溶,且溶解后得到滤渣和 Na 3 AsO 4 溶液;故 “ 溶解 ” 步骤中滤渣为未溶解的 CuS 、 PbS ;
( 4 )
“ 溶解 ” 时,氧气中氧元素化合价降低为氧化剂, HAsO 2 中砷元素化合价升高得到 Na 3 AsO 4 为还原剂,根据电子守恒可知,发生反应的氧化剂和还原剂的物质的量之比为 1 : 2 ;实验测得 Na 3 AsO 4 溶液呈碱性,其原因为砷酸根离子水解生成氢氧根离子 AsO + H 2 O ⇌ HAsO
+OH - ;
( 5 )
Na 3 AsO 4 生成 As 2 O 3 ,砷元素化合价降低,转移电子情况为 As 2 O 3 ~4e - ; SO 2 变为硫酸根化合价升高,转移电子情况为 SO 2 ~2e - ;根据电子守恒可知 As 2 O 3 ~4e - ~2SO 2 ,则 “ 还原 ” 时消耗标准状况下 SO 2 的体积为 22.4 L 。

