
下列关于工业生产过程的叙述正确的是
A .联合制碱法中循环使用 CO 2 和 NH 3 ,以提高原料利用率
B .硫酸工业中, SO 2 氧化为 SO 3 时采用常压,因为高压会降低 SO 2 转化率
C .合成氨生产中将 NH 3 液化分离,可加快正反应速率,提高 N 2 、 H 2 的转化率
D . SO 2 在接触室被氧化成 SO 3 , SO 3 在吸收塔内被吸收制成浓硫酸
D
【解析】
【详解】
A .联合制碱法中,碳酸氢钠受热分解生成碳酸钠和二氧化碳,二氧化碳被循环利用,而氯化铵并没有直接循环利用,而是作为其他化工原料,则氨气没有被循环利用,故 A 错误;
B .对于该反应,常压时转化率就很高了,增大压强对 SO 2 的转化率影响不大,同时会增大成本,故通常采用常压而不是高压,故 B 错误;
C .合成氨生产过程中将 NH 3 液化分离,导致生成物浓度减小,逆反应速率瞬间减小,正反应速率随之减小,平衡向正反应方向移动,从而提高了 N 2 、 H 2 的转化率,故 C 错误;
D . SO 2 在接触室被氧化成 SO 3 , SO 3 在吸收塔内被吸收制成浓硫酸,故 D 正确;
答案选 D 。
水体砷污染已成为一个亟待解决的全球性环境问题,我国科学家研究零价铁活化过硫酸钠(Na2S2O8)去除废水中的正五价砷[As(V )],其机制模型如图。
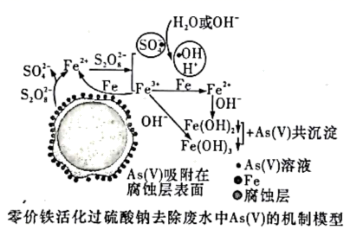
资料:
I.酸性条件下![]() ●为主要的自由基,中性及弱碱性条件下
●为主要的自由基,中性及弱碱性条件下![]() ●和●OH同时存在,强碱性条件下,●OH为主要的自由基。
●和●OH同时存在,强碱性条件下,●OH为主要的自由基。
II. Fe2+、Fe3+形成氢氧化物沉淀的pH
| 离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe2+ | 7.04 | 9.08 |
| Fe3+ | 1.87 | 3.27 |
(1)砷与磷在元素周期表中位于同一主族,其原子比磷多一个电子层。
①砷在元素周期表中的位置是____________________。
②砷酸的化学式是__________________________,其酸性比H3PO4__________________________
(填“强”或“弱”)。
(2)零价铁与过硫酸钠反应,可持续释放Fe2+,Fe2+与![]() 反应生成Fe3+和自由基,自由基具有强氧化性,利于形成Fe2+和Fe3+,以确保As( V)去除完全。
反应生成Fe3+和自由基,自由基具有强氧化性,利于形成Fe2+和Fe3+,以确保As( V)去除完全。
①零价铁与过硫酸钠反应的离子方程式是________________________。
②Fe3+转化为Fe2+的离子方程式是________________________________。
(3)不同pH对As(V)去除率的影响如图。5 min内pH=7和pH=9时去除率高的原因是________________。

下表各组物质(或者它们的溶液)通过一步反应可实现如图所示的转化的是
| 选项 | X | Y | Z |
|
| A | Si | Na2SiO3 | H2SiO3 | |
| B | S | H2S | SO2 | |
| C | Al2O3 | NaAlO2 | Al2(SO4)3 | |
| D | Mg(OH)2 | MgCO3 | MgCl2 |
A.A B.B C.C D.D