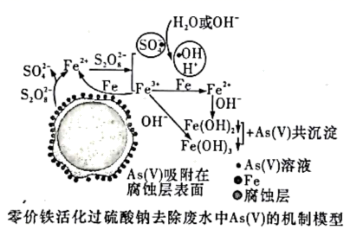
水体砷污染已成为一个亟待解决的全球性环境问题,我国科学家研究零价铁活化过硫酸钠(Na2S2O8)去除废水中的正五价砷[As(V )],其机制模型如图。
资料:
I.酸性条件下![]() ●为主要的自由基,中性及弱碱性条件下
●为主要的自由基,中性及弱碱性条件下![]() ●和●OH同时存在,强碱性条件下,●OH为主要的自由基。
●和●OH同时存在,强碱性条件下,●OH为主要的自由基。
II. Fe2+、Fe3+形成氢氧化物沉淀的pH
| 离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe2+ | 7.04 | 9.08 |
| Fe3+ | 1.87 | 3.27 |
(1)砷与磷在元素周期表中位于同一主族,其原子比磷多一个电子层。
①砷在元素周期表中的位置是____________________。
②砷酸的化学式是__________________________,其酸性比H3PO4__________________________
(填“强”或“弱”)。
(2)零价铁与过硫酸钠反应,可持续释放Fe2+,Fe2+与![]() 反应生成Fe3+和自由基,自由基具有强氧化性,利于形成Fe2+和Fe3+,以确保As( V)去除完全。
反应生成Fe3+和自由基,自由基具有强氧化性,利于形成Fe2+和Fe3+,以确保As( V)去除完全。
①零价铁与过硫酸钠反应的离子方程式是________________________。
②Fe3+转化为Fe2+的离子方程式是________________________________。
(3)不同pH对As(V)去除率的影响如图。5 min内pH=7和pH=9时去除率高的原因是________________。

答案
第4周期第VA族 H3AsO4 弱 ![]() Fe+ 2Fe3+ =3Fe2+ pH=7和pH=9时,产生了具有强氧化性的
Fe+ 2Fe3+ =3Fe2+ pH=7和pH=9时,产生了具有强氧化性的![]() ●和●OH,利于生成Fe2+和Fe3+ ,pH=7和pH=9时,Fe2+和Fe3+形成Fe(OH)2和Fe(OH)3与As( V )发生共沉淀,有效去除As(V)
●和●OH,利于生成Fe2+和Fe3+ ,pH=7和pH=9时,Fe2+和Fe3+形成Fe(OH)2和Fe(OH)3与As( V )发生共沉淀,有效去除As(V)
【分析】
图中信息显示:![]() 能将Fe氧化为Fe2+;
能将Fe氧化为Fe2+;![]() 与Fe2+作用,生成具有强氧化性的
与Fe2+作用,生成具有强氧化性的![]() ●和Fe3+;
●和Fe3+;![]() ●与H2O或OH-作用,生成●OH自由基;自由基具有强氧化性,利于形成Fe2+和Fe3+;在碱性溶液中,Fe2+和Fe3+形成Fe(OH)2和Fe(OH)3,与As( V )发生共沉淀,有效去除As(V)。
●与H2O或OH-作用,生成●OH自由基;自由基具有强氧化性,利于形成Fe2+和Fe3+;在碱性溶液中,Fe2+和Fe3+形成Fe(OH)2和Fe(OH)3,与As( V )发生共沉淀,有效去除As(V)。
【详解】
(1)①砷与磷的最外层电子数都为5,在元素周期表中位于第VA族,磷位于第三周期,则砷位于第四周期。由此得出砷在元素周期表中的位置是第4周期第VA族。
②磷酸的化学式为H3PO4,则砷酸的化学式是H3AsO4;同主族元素从上到下,非金属性依次增强,则酸性依次增强,所以其酸性比H3PO4弱。答案为:第4周期第VA族;H3AsO4;弱;
(2)①由图中可以看出,零价铁与过硫酸钠反应生成![]() 和Fe2+,离子方程式是
和Fe2+,离子方程式是![]() 。
。
②Fe3+与Fe反应转化为Fe2+,离子方程式是Fe+ 2Fe3+ =3Fe2+。答案为:![]() ;Fe+ 2Fe3+ =3Fe2+;
;Fe+ 2Fe3+ =3Fe2+;
(3)由信息知,中性及弱碱性条件下![]() ●和●OH同时存在,自由基具有强氧化性,利于形成Fe2+和Fe3+,以确保As( V)去除完全。由此得出5 min内pH=7和pH=9时去除率高的原因是pH=7和pH=9时,产生了具有强氧化性的
●和●OH同时存在,自由基具有强氧化性,利于形成Fe2+和Fe3+,以确保As( V)去除完全。由此得出5 min内pH=7和pH=9时去除率高的原因是pH=7和pH=9时,产生了具有强氧化性的![]() ●和●OH,利于生成Fe2+和Fe3+ ,pH=7和pH=9时,Fe2+和Fe3+形成Fe(OH)2和Fe(OH)3,与As( V )发生共沉淀,有效去除As(V)。答案为:pH=7和pH=9时,产生了具有强氧化性的
●和●OH,利于生成Fe2+和Fe3+ ,pH=7和pH=9时,Fe2+和Fe3+形成Fe(OH)2和Fe(OH)3,与As( V )发生共沉淀,有效去除As(V)。答案为:pH=7和pH=9时,产生了具有强氧化性的![]() ●和●OH,利于生成Fe2+和Fe3+ ,pH=7和pH=9时,Fe2+和Fe3+形成Fe(OH)2和Fe(OH)3,与As( V )发生共沉淀,有效去除As(V)。
●和●OH,利于生成Fe2+和Fe3+ ,pH=7和pH=9时,Fe2+和Fe3+形成Fe(OH)2和Fe(OH)3,与As( V )发生共沉淀,有效去除As(V)。
【点睛】
因为磷与砷是同主族元素,所以我们采用类推法,可确定砷在元素周期表中的位置及最高价含氧酸的化学式。