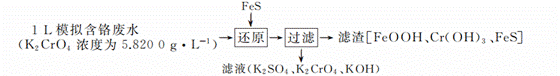
海水是巨大的资源宝库,如图是人类从海水资源中提取某些重要化工原料的简单流程示意图
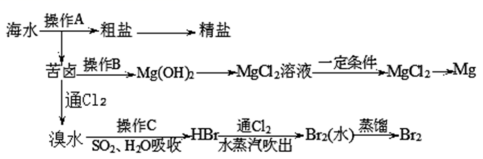
请回答下列问题
(1) 操作 A 是蒸发结晶和 ___________ ( 填实验基本操作名称 )
(2)① 工业上常用于沉淀 Mg 2+ 的试剂是 ___________
② 电解熔融的无水氯化镁所得的镁蒸汽在特定的环境中冷却后即为固体镁。下列物质中可以用作镁蒸汽的冷却剂的是 ___________ ( 填字母 )
A . Ar B .氮气 C . O 2 D .水蒸气
(3) 工业上由无水 MgCl 2 制取镁的化学方程式为 ___________
(4) 向苦卤中通入 Cl 2 ,发生反应的离子方程式是 ___________ ,用 SO 2 水溶液吸收 Br 2 ,吸收率可达 95% ,有关反应的离子方程式为 ___________
(5) 从海水中提取溴约占世界溴年产量的 ,从海水中提取溴据上述图的主要步骤表示为 ____
A .氧化 → 吸收 → 吹出 → 氧化 B .氧化 → 吸收 → 氧化 → 吹出 → 蒸馏
C .吹出 → 氧化 → 吸收 → 氧化 D .氧化 → 吹出 → 吸收 → 氧化 → 蒸馏
答案
过滤 Ca(OH) 2 (或 NaOH ) A MgCl 2 ( 熔融 ) Mg + Cl 2 ↑ Cl 2 + 2Br - =Br 2 + 2Cl - Br 2 + SO 2 + 2H 2 O=4H + + SO
+ 2Br - B
【分析】
海水晒盐过滤得到苦卤和粗盐,粗盐精制得到精盐,苦卤中加入石灰乳沉淀镁离子形成氢氧化镁沉淀,过滤得到氢氧化镁沉淀中加入盐酸溶解得到氯化镁溶液,蒸发浓缩,冷却结晶得到氯化镁晶体,在氯化氢气流中加热得到氯化镁,电解熔融氯化镁得到金属镁;苦卤中通入氯气氧化溴离子为单质溴,用二氧化硫水溶液吸收溴单质,得到 HBr ,再通入氯气氧化溴化氢得到溴单质,富集溴元素,用水蒸气吹出蒸馏得到液溴。
【详解】
(1) 食盐的溶解度受温度变化影响较小,可以通过蒸发结晶的方法得到氯化钠,结晶后过滤分离,则操作 A 是蒸发结晶和过滤,故答案为:过滤;
(2)① 工业上常用于沉淀 Mg 2+ 的试剂是 Ca(OH) 2 (或 NaOH ),故答案为: Ca(OH) 2 (或 NaOH );
② 电解熔融的无水氯化镁所得的镁蒸汽在特定的环境中冷却后即为固体镁,金属镁与氮气、氧气和水蒸气都可以反应,所以可以用作镁蒸汽的冷却剂的是 Ar ,故答案为: A ;
(3) 工业上电解熔融 MgCl 2 制取镁,化学方程式为: MgCl 2 ( 熔融 ) Mg + Cl 2 ↑ ;
(4) 氯气氧化溴离子得到单质溴,离子方程式为: Cl 2 + 2Br - =Br 2 + 2Cl - ;用 SO 2 水溶液吸收 Br 2 ,发生氧化还原反应,有关反应的离子方程式为 Br 2 + SO 2 + 2H 2 O=4H + + SO + 2Br - ;
(5) 根据上述分析,海水中提取溴据上述图的主要步骤表示为:氧化 → 吸收 → 氧化 → 吹出 → 蒸馏,故答案为: B 。