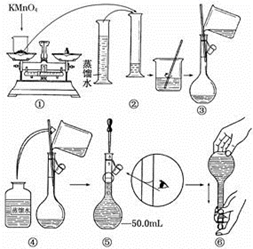
粗食盐常含有少量 Ca 2+ 、 Ma 2+ 、 以及泥沙等杂质,实验室提纯 NaCl 的流程如下 ( 加入的试剂稍过量 )
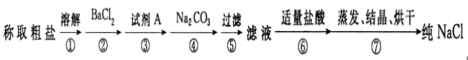
(1) 步骤 ③中加入的试剂 A 是 _______ ( 填化学式 ) 。
(2) 步骤 ④中,相关的离子方程式 ______ 、 _______ 。
(3) 若将步骤 ⑤与步骤⑥对调,先用盐酸调 pH 再过滤,将对实验结果产生的影响是 ______ 。
(4) 用提纯的 NaCl 配制 100mL 1.0mol/L 的 NaCl 溶液,所用仪器除烧杯、玻璃棒、胶头滴管、药匙外,还需要 ( 填仪器名称 ) _____ 。
(5) 实验室提纯 NaCl 的过程中,在溶液、过滤、蒸发三个步骤的操作中都要用到玻璃棒,其中在蒸发时,使用玻璃棒的目的 __ 。
答案
NaOH Ca 2+ + =CaCO 3 ↓ Ba 2+ +
=BaCO 3 ↓ 先加 HCl 会有少量 CaCO 3 、 BaCO 3 、 Mg ( OH ) 2 沉淀溶解,使 NaCl 混有杂质,从而影响制得 NaCl 的纯度 托盘天平、 100mL 容量瓶 防止局部过热液滴或晶体飞溅
【分析】
( 1 )根据杂质离子及结合步骤 ②和步骤④已经选用的试剂分析;
( 2 )粗盐提纯时,加入碳酸钠可以将钙离子和多余的钡离子除去,写出生成碳酸钙、碳酸钡的化学方程式;
( 3 ) CaCO 3 、 BaCO 3 、 Mg ( OH ) 2 沉淀可以溶解在盐酸中,生成一部分杂质,除杂效果不好;
( 4 )根据配制一定物质的量浓度的溶液用到的仪器来回答;
( 5 )蒸发时通过玻璃棒的搅拌作用,使溶液或晶体受热均匀。
【详解】
( 1 )杂质离子为硫酸根离子、钙离子和镁离子,步骤 ②加入氯化钡溶液除去了硫酸根离子,步骤④加入碳酸钠溶液除去了钙离子,所以步骤③应该是加入 NaOH 溶液除去镁离子,故答案为: NaOH ;
( 2 )步骤 ④加入碳酸钠溶液,除去溶液中的钙离子及过量氯化钡引进的钡离子杂质,反应的化学方程式为: CaCl 2 +Na 2 CO 3 ═CaCO 3 ↓+2NaCl ; BaCl 2 +Na 2 CO 3 ═BaCO 3 ↓+2NaCl ,故离子反应方程式为: Ca 2+ + =CaCO 3 ↓ , Ba 2+ +
=BaCO 3 ↓ ,故答案为: Ca 2+ +
=CaCO 3 ↓ ; Ba 2+ +
=BaCO 3 ↓ ;
( 3 )由于盐酸能够与碳酸钡、碳酸钙、氢氧化镁发生反应,先用盐酸调 pH 再过滤,导致少量 CaCO 3 、 BaCO 3 、 Mg ( OH ) 2 沉淀溶解,使 NaCl 混有杂质,故答案为:先加 HCl 会有少量 CaCO 3 、 BaCO 3 、 Mg ( OH ) 2 沉淀溶解,使 NaCl 混有杂质,从而影响制得 NaCl 的纯度;
( 4 )用提纯的 NaCl 配制 100mL 1.0mol/L 的 NaCl 溶液,所用仪器有:烧杯、玻璃棒、胶头滴管、药匙、 100mL 容量瓶、托盘天平,所以还需要的仪器为托盘天平,故答案为:托盘天平、 100mL 容量瓶;
( 5 )在蒸发时,使用玻璃棒进行搅拌,能够受热均匀,可以防止局部过热液滴或晶体飞溅,
故答案为:防止局部过热液滴或晶体飞溅。