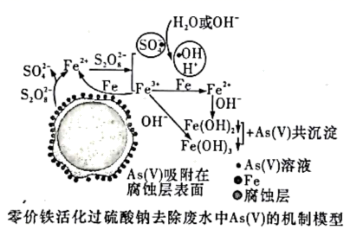
工业制备下列物质的方案中正确的是 ( )
A .
B .
C .
答案
C
【详解】
A .工业制备氯气应该用电解饱和食盐水的方法,而且二氧化锰和浓盐酸常温下也不反应,故 A 错误;
B .二氧化硫要想转化为三氧化硫需要催化剂,加热,故 B 错误;
C .饱和氯化钠溶液中先通入易溶于水的氨气,再通入二氧化碳,生成碳酸氢钠,再加热分解得到纯碱,这是侯氏制碱法的工业流程,故 C 正确;
D .从海水中提镁应该本着经济、节约资源的原则,不选用氢氧化钠做沉淀剂,而是从煅烧贝壳 (主要成分为碳酸钙)得到生石灰,生石灰与水反应得到氢氧化钙,用氢氧化钙做沉淀剂,经济实惠,故 D 错误;
故答案为: C。