新型冠状病毒是一种被脂质和核蛋白外壳保护层覆盖着的正链单股 。对紫外线和热敏感。
30 分钟、医用酒精、含氯消毒剂、过氧乙酸和氯仿等脂溶剂均可有效灭活病毒。下列有关说法 不正确 的是 ( )
A . 过氧乙酸为强氧化剂,有漂白作用。高浓度药液具有强腐蚀性、刺激性,如不慎溅到皮肤上应立即用水冲洗
B . 84 消毒液与酒精不可混用,因为两者可能会发生化学反应产生氯气等有毒物质
C . 医用消毒酒精是 的乙醇溶液
D . 三聚异氰尿酸 ( 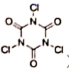 ) 是一种固体含氯消毒剂,相比于 “84”( 有效氯含量约
) 是一种固体含氯消毒剂,相比于 “84”( 有效氯含量约 ) 消毒液,它有效氯含量更高、释放时间更长
C
【详解】
A .过氧乙酸有强氧化性,有漂白作用,如果过氧乙酸不慎溅到皮肤上应立即用大量水冲洗, A 项正确;
B . 84 消毒液中含有次氯酸钠与乙醇发生反应,故二者不可以混用,两者会发生化学反应产生氯气等有毒物质, B 项正确;
C .医用消毒酒精是 的乙醇溶液, C 项错误;
D .三聚异氰尿酸 ( 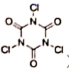 ) 是一种固体含氯消毒剂,相比于 “84” 消毒液,它有效氯含量更高、释放时间更长, D 项正确;
) 是一种固体含氯消毒剂,相比于 “84” 消毒液,它有效氯含量更高、释放时间更长, D 项正确;
答案选 C 。
下列关于科学家及其提出学说与贡献的叙述不正确的是
A . 1869 年,俄国化学家门捷列夫制出了第一张元素周期表
B . 我国化学家侯德榜制碱法的最终产物是纯碱 (Na 2 CO 3 )
C . 舍勒发现了氯气,并将这种气体的组成元素命名为 chlorine
D . 卢瑟福根据 α 粒子散射现象,提出了带核的原子结构模型
C
【详解】
A . 1869 年,俄国化学家门捷列夫将元素按相对原子质量大小由小到大依次排列,并将化学性质相似的元素放在一个纵行,制出了第一张元素周期表,故 A 正确;
B .我国化学家侯德榜改进了制碱工艺,发明了联合制碱法,即 NH 3 +CO 2 +H 2 O+NaCl=NaHCO 3 ↓+ NH 4 Cl , 2NaHCO 3 Na 2 CO 3 +H 2 O+CO 2 ↑,最终产物是纯碱 (Na 2 CO 3 ) ,为化学工业做出了重大贡献,故 B 正确;
C . 1774 年瑞典化学家舍勒在研究软锰矿时发现了氯气,后来戴维将这种气体的组成元素命名为 chlorine ,故 C 错误;
D . 1911 年英国物理学家卢瑟福根据 α 粒子散射现象,提出了带核的原子结构模型,故 D 正确;
答案为 C 。
工业制备下列物质的方案中正确的是 ( )
A .
B .
C .
C
【详解】
A .工业制备氯气应该用电解饱和食盐水的方法,而且二氧化锰和浓盐酸常温下也不反应,故 A 错误;
B .二氧化硫要想转化为三氧化硫需要催化剂,加热,故 B 错误;
C .饱和氯化钠溶液中先通入易溶于水的氨气,再通入二氧化碳,生成碳酸氢钠,再加热分解得到纯碱,这是侯氏制碱法的工业流程,故 C 正确;
D .从海水中提镁应该本着经济、节约资源的原则,不选用氢氧化钠做沉淀剂,而是从煅烧贝壳 (主要成分为碳酸钙)得到生石灰,生石灰与水反应得到氢氧化钙,用氢氧化钙做沉淀剂,经济实惠,故 D 错误;
故答案为: C。
下列过程中不涉及分解反应的是 ( )
A . 电解法制备金属镁 B . 水滴石穿
C . 《石灰吟》中的 “ 烈火煅烧 D . 氯水久置酸性增强
B
【详解】
A .电解法制备金属镁 MgCl 2 Mg+Cl 2 ↑ ,是分解反应,故 A 正确;
B .水滴石穿原理:碳酸钙与二氧化碳和水反应生成易溶于水的碳酸氢钙,即 CaCO 3 +CO 2 +H 2 O═Ca(HCO 3 ) 2 ,是化合反应,故 B 错误;
C .烈火煅烧是石灰石煅烧分解生成 CaO 和二氧化碳: CaCO 3 CaO+CO 2 ↑ ,是分解反应,故 C 正确;
D .氯气和水的反应生成 HClO ,新制的氯水久置时发生 HClO 分解生成 HCl 和 O 2 ,生成的 HCl 导致溶液酸性增强,反应化学方程式为: 2HClO=2HCl+ O 2 ↑ ,是分解反应,故 D 正确;
故选: B 。
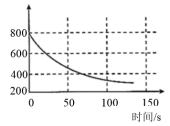
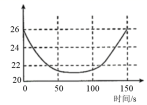
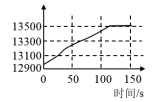
某学习小组拟用手持技术对光照过程中新制饱和氯水的变化进行检测,图像正确的是 ( )
| A | B | C | D |
| | | | |
| 氯水的 pH 随时间的变化 | 溶液中氯离子浓度随时间的变化 | 氯水的电导率随时间的变化 | 液面上方氧气体积分数随时间的变化 |
A . A B . B C . C D . D
D
【详解】
A .氯水中存在 HClO , HClO 不稳定分解: 2HClO 2HCl+O 2 ↑,随着 HClO 的分解,最终会变为盐酸,氢离子浓度增大,溶液 pH 不断减小,故 A 错误;
B .随着 HClO 的分解,水中的 Cl 2 +H 2 O ⇌ HClO+HCl 平衡会向右移动,氯离子浓度不断增大,故 B 错误;
C .溶液中离子浓度增大,溶液的导电能力与离子浓度成正比,电导率不断增大,最终会变为盐酸,电导率不变,故 C 错误;
D . 2HClO 2HCl+O 2 ↑反应生成氧气,氧气体积分数不断增大,最终保持不变,故 D 正确;
故选 D 。
本卷还有95题,登录并加入会员即可免费使用哦~

该作品由: 用户袁志刚分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。