某小组探究Na2SO3溶液和KIO3溶液的反应。
实验I:向某浓度的KIO3酸性溶液(过量)中加入Na2SO3溶液(含淀粉),一段时间(t秒)后,溶液突然变蓝。
资料:IO3-在酸性溶液氧化I-,反应为IO3- + 5I- + 6H+ = 3I2 + 3H2O
(1)溶液变蓝,说明Na2SO3具有_________性。
(2)针对t秒前溶液未变蓝,小组做出如下假设:
i.t秒前未生成I2,是由于反应的活化能______(填“大”或“小”),反应速率慢导致的。
ii.t秒前生成了I2,但由于存在Na2SO3,_____(用离子方程式表示),I2被消耗。
(3)下述实验证实了假设ii合理。
实验II:向实验I的蓝色溶液中加入_______,蓝色迅速消失,后再次变蓝。
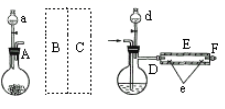
(4)进一步研究Na2SO3溶液和KIO3溶液反应的过程,装置如下。
实验III:K闭合后,电流表的指针偏转情况记录如下表:
| 表盘 | |
| ||
| 时间/min | 0~t1 | t2~t3 | t4 | |
| 偏转 位置 | 右偏至Y | 指针回到“0”处,又返至“X”处;如此周期性往复多次…… | 指针 归零 | |
① K闭合后,取b极区溶液加入盐酸酸化的BaCl2溶液,现象是______。
② 0~t1时,从a极区取溶液于试管中,滴加淀粉溶液,溶液变蓝;直接向a极区滴加淀粉溶液,溶液未变蓝。判断IO3- 在a极放电的产物是_______。
③ 结合反应解释t2~t3时指针回到“0”处的原因:________。
(5)综合实验I、II、III,下列说法正确的是_______。
A.对比实验I、II,t秒后溶液变蓝,I中SO32-被完全氧化
B.对比实验I、III,t秒前IO3- 未发生反应
C.实验III中指针返回X处的原因,可能是I2氧化SO32-
答案
还原 大 ![]() 少量
少量![]() 生成白色沉淀
生成白色沉淀 ![]() 此时,a极区发生反应IO3- + 5I- + 6H+ = 3I2 + 3H2O ,IO3- 不再与SO32-发生反应,外电路无电流通过 AC
此时,a极区发生反应IO3- + 5I- + 6H+ = 3I2 + 3H2O ,IO3- 不再与SO32-发生反应,外电路无电流通过 AC
【详解】
(1)向某浓度的KIO3酸性溶液(过量)中加入Na2SO3溶液(含淀粉),一段时间(t秒)后,溶液突然变蓝。说明溶液中生成了I2,IO3-中I的化合价从+5降低到0,硫的化合价升高,则Na2SO3具有还原性,答案为还原;
(2)i.一般情况下活化能大,化学反应速率慢,答案为大;
ii. I2具有氧化性,SO32-具有还原性,能够发生氧化还原反应,则I2被还原成I-,SO32-被氧化成SO42-,根据得失电子守恒和原子守恒,配平方程式。答案为I2+SO32-+H2O=2I-+SO42-+2H+;
(3)为了证明假设ii的合理性,即生成的I2会由于Na2SO3的存在,而与之反应,使得溶液不再呈蓝色,则需要在含有I2的溶液中,加入少量的Na2SO3溶液,与I2反应,使蓝色消失,答案为少量Na2SO3;
(4)0~t1,指针右偏至Y,说明有电流产生,发生了氧化还原反应,t2~t3,指针回到“0”处,又返至“X”处;如此周期性往复多次……中间有一段时间,回路中没有电流产生,之后往复,直到亚硫酸钠完全反应完。
①闭合开关后,指针有偏转,有发生反应说明SO32-被氧化成了SO42-。加入盐酸酸化的BaCl2溶液,有白色沉淀生成。答案为生成白色沉淀;
②0~t1时,直接向a极区滴加淀粉溶液,溶液未变蓝,但是又发生了反应,根据假设,生成的碘单质与SO32-反应,生成了I-,答案为I-;
③t2~t3时指针回到“0”处,说明电路中没有电流,SO32-没有参与反应,但是随后又有电流产生,而且偏转到X,说明有碘单质生成,是碘酸根和碘离子的反应,答案为此时,a极区发生反应IO3- + 5I- + 6H+ = 3I2 + 3H2O ,IO3- 不再与SO32-发生反应,外电路无电流通过;
(5)A.如果有SO32-存在,SO32-会与I2反应,现溶液呈现蓝色,说明存在I2,没有SO32-,A正确;B. 对比实验I、III,t秒前IO3-还原成I-,而不是I2,有发生变化,B项错误;C.指针回到0,电路中没有发生反应,发生的反应是IO3- + 5I- + 6H+ = 3I2 + 3H2O,但是随后指针又转到x,说明又与SO32-反应,产生电流。如果是IO3-与SO32-反应,指针会指到Y,所以是I2与SO32-反应,C正确;答案为AC。
【点睛】
本题题目非常新颖,但是只要抓住反应顺序,开始为IO3-与SO32-生成碘单质,I2再和SO32-反应,生成I-,再I-和IO3-反生碘单质,如此往复。