我国科学家研发了一种室温下“可呼吸”的Na-CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是( )
2Na2CO3+C。下列说法错误的是( )
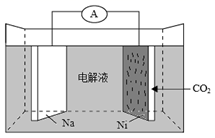
A.放电时,ClO4-向负极移动
B.充电时释放CO2,放电时吸收CO2
C.放电时,正极反应为:3CO2+4e-=2CO32-+C
D.充电时,正极反应为:Na++e-=Na
D
【分析】
原电池中负极发生失去电子的氧化反应,正极发生得到电子的还原反应,阳离子向正极移动,阴离子向负极移动,充电可以看作是放电的逆反应,据此解答。
【详解】
A. 放电时是原电池,阴离子ClO4-向负极移动,A正确;
B. 电池的总反应为3CO2+4Na![]() 2Na2CO3+C,因此充电时释放CO2,放电时吸收CO2,B正确;
2Na2CO3+C,因此充电时释放CO2,放电时吸收CO2,B正确;
C. 放电时是原电池,正极是二氧化碳得到电子转化为碳,反应为:3CO2+4e−=2CO32-+C,C正确;
D. 充电时是电解,正极与电源的正极相连,作阳极,发生失去电子的氧化反应,反应为2CO32-+C-4e−=3CO2,D错误。答案选D。
【点睛】
本题以我国科学家发表在化学顶级刊物上的“一种室温下可呼吸的钠、二氧化碳二次电池”为载体考查了原电池和电解池的工作原理,掌握原电池和电解池的工作原理是解答的关键,注意充电与放电关系的理解。本题很好的弘扬了社会主义核心价值观个人层面的爱国精神,落实了立德树人的教育根本任务。
一种可充电锂-空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法正确的是( )
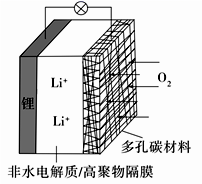
A.放电时,多孔碳材料电极为负极
B.放电时,外电路电子由多孔碳材料电极流向锂电极
C.充电时,电解质溶液中Li+向多孔碳材料区迁移
D.充电时,电池总反应为Li2O2-x=2Li+(1—![]() )O2
)O2
D
【详解】
A.放电时,O2与Li+在多孔碳电极处反应,说明电池内,Li+向多孔碳电极移动,因为阳离子移向正极,所以多孔碳电极为正极,A错误;
B.因为多孔碳电极为正极,外电路电子应该由锂电极流向多孔碳电极(由负极流向正极),B错误;
C.充电和放电时电池中离子的移动方向应该相反,放电时,Li+向多孔碳电极移动,充电时向锂电极移动,C错误;
D.根据图示和上述分析,电池的正极反应是O2与Li+得电子转化为Li2O2-X,电池的负极反应是单质Li失电子转化为Li+,所以总反应为:2Li + (1—![]() )O2 = Li2O2-X,充电的反应与放电的反应相反,所以为Li2O2-X = 2Li +(1—
)O2 = Li2O2-X,充电的反应与放电的反应相反,所以为Li2O2-X = 2Li +(1—![]() )O2,选项D正确;
)O2,选项D正确;
答案选D。
利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。下列说法错误的是
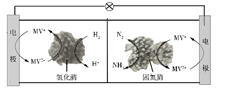
A.相比现有工业合成氨,该方法条件温和,同时还可提供电能
B.阴极区,在氢化酶作用下发生反应H2+2MV2+![]() 2H++2MV+
2H++2MV+
C.正极区,固氮酶为催化剂,N2发生还原反应生成NH3
D.电池工作时质子通过交换膜由负极区向正极区移动
B
【分析】
由生物燃料电池的示意图可知,左室电极为燃料电池的负极,MV+在负极失电子发生氧化反应生成MV2+,电极反应式为MV+—e—= MV2+,放电生成的MV2+在氢化酶的作用下与H2反应生成H+和MV+,反应的方程式为H2+2MV2+=2H++2MV+;右室电极为燃料电池的正极,MV2+在正极得电子发生还原反应生成MV+,电极反应式为MV2++e—= MV+,放电生成的MV+与N2在固氮酶的作用下反应生成NH3和MV2+,反应的方程式为N2+6H++6MV+=6MV2++NH3,电池工作时,氢离子通过交换膜由负极向正极移动。
【详解】
A项、相比现有工业合成氨,该方法选用酶作催化剂,条件温和,同时利用MV+和MV2+的相互转化,化学能转化为电能,故可提供电能,故A正确;
B项、左室为负极区,MV+在负极失电子发生氧化反应生成MV2+,电极反应式为MV+—e—= MV2+,放电生成的MV2+在氢化酶的作用下与H2反应生成H+和MV+,反应的方程式为H2+2MV2+=2H++2MV+,故B错误;
C项、右室为正极区,MV2+在正极得电子发生还原反应生成MV+,电极反应式为MV2++e—= MV+,放电生成的MV+与N2在固氮酶的作用下反应生成NH3和MV2+,故C正确;
D项、电池工作时,氢离子(即质子)通过交换膜由负极向正极移动,故D正确。
故选B。
【点睛】
本题考查原池原理的应用,注意原电池反应的原理和离子流动的方向,明确酶的作用是解题的关键。
全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法错误的是
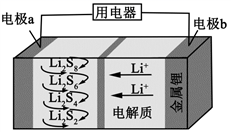
A.电池工作时,正极可发生反应:2Li2S6+2Li++2e−=3Li2S4
B.电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 g
C.石墨烯的作用主要是提高电极a的导电性
D.电池充电时间越长,电池中Li2S2的量越多
D
【详解】
A.原电池工作时,Li+向正极移动,则a为正极,正极上发生还原反应,随放电的多少可能发生多种反应,其中可能为2Li2S6+2Li++2e-=3Li2S4,故A正确;B.原电池工作时,转移0.02mol电子时,氧化Li的物质的量为0.02mol,质量为0.14g,故B正确;C.石墨能导电,利用石墨烯作电极,可提高电极a的导电性,故C正确;D.电池充电时间越长,转移电子数越多,生成的Li和S8越多,即电池中Li2S2的量越少,故D错误;答案为D。
化学电源在日常生活和高科技领域中都有广泛应用。下列说法不正确的是
A.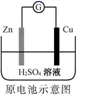 Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
B. 正极的电极反应式为Ag2O+2e−+H2O
正极的电极反应式为Ag2O+2e−+H2O![]() 2Ag+2OH−
2Ag+2OH−
C. 锌筒作负极,发生氧化反应,锌筒会变薄
锌筒作负极,发生氧化反应,锌筒会变薄
D. 使用一段时间后,电解质溶液的酸性减弱,导电能力下降
使用一段时间后,电解质溶液的酸性减弱,导电能力下降
A
【详解】
A.Zn较Cu活泼,做负极,Zn失电子变Zn2+,电子经导线转移到铜电极,铜电极负电荷变多,吸引了溶液中的阳离子,因而Zn2+和H+迁移至铜电极,H+氧化性较强,得电子变H2,因而c(H+)减小,A项错误;
B. Ag2O作正极,得到来自Zn失去的电子,被还原成Ag,结合KOH作电解液,故电极反应式为Ag2O+2e−+H2O![]() 2Ag+2OH−,B项正确;
2Ag+2OH−,B项正确;
C.Zn为较活泼电极,做负极,发生氧化反应,电极反应式为Zn-2e-=Zn2+,锌溶解,因而锌筒会变薄,C项正确;
D.铅蓄电池总反应式为PbO2 + Pb + 2H2SO4 ![]() 2PbSO4 + 2H2O,可知放电一段时间后,H2SO4不断被消耗,因而电解质溶液的酸性减弱,导电能力下降,D项正确。
2PbSO4 + 2H2O,可知放电一段时间后,H2SO4不断被消耗,因而电解质溶液的酸性减弱,导电能力下降,D项正确。
故答案选A。
本卷还有95题,登录并加入会员即可免费使用哦~

该作品由: 用户向文浩分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。