Cl2是一种重要的化学原料,在生产和生活中应用十分广泛。
(1)氯水中HClO具有漂白性,能杀菌消毒。其电子式为__。
(2)实验室可用KMnO4和浓盐酸反应制取Cl2,反应的离子方程式是__。
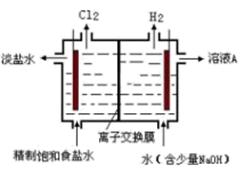
(3)工业上可采取电解饱和食盐水的方法制取Cl2,装置如图所示,图中的离子交换膜为__(填“阳”或“阴”)离子交换膜。
(4)以HCl为原料,用O2氧化制取Cl2,可提高效益,减少污染。反应如下:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) △H=-115.4kJ·mol-1
2Cl2(g)+2H2O(g) △H=-115.4kJ·mol-1
上述反应在同一反应器中,通过控制合适条件,分两步循环进行,可使HCl转化率接近100%,其基本原理如图所示:
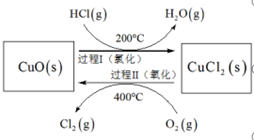
过程Ⅰ的反应为:2HCl(g)+CuO(s)![]() CuCl2(s)+H2O(g) △H1=-120.4kJ·mol-1
CuCl2(s)+H2O(g) △H1=-120.4kJ·mol-1
①过程Ⅱ反应的热化学方程式为__。
②过程Ⅰ流出的气体通过稀NaOH溶液(含少量酚酞)进行检测,氯化初期主要为不含HCl的气体,判断氯化结束时溶液的现象为__。
③相同条件下,若将氯化温度升高到300℃,溶液中出现上述现象的时间将缩短,其原因为__。
答案
![]() 2MnO
2MnO![]() +16H++10Cl-=2Mn2++5Cl2↑+8H2O 阳 2CuCl2(s)+O2(g)=2CuO(s)+2Cl2(g) ΔH2=+125.4kJ·mol-1 溶液由红色变为无色 温度升高,反应速率加快,且氯化程度减少
+16H++10Cl-=2Mn2++5Cl2↑+8H2O 阳 2CuCl2(s)+O2(g)=2CuO(s)+2Cl2(g) ΔH2=+125.4kJ·mol-1 溶液由红色变为无色 温度升高,反应速率加快,且氯化程度减少
【详解】
(1)次氯酸是共价化合物,电子式为:![]() ;
;
(2)实验室可用KMnO4和浓盐酸反应制取Cl2,反应的离子方程式是2MnO![]() +16H++10Cl-=2Mn2++5Cl2↑+8H2O;
+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
(3)阳极发生氧化反应,氯离子放电,产生氯气,为防止氯气和氢氧化钠反应,图中的离子交换膜应该为阳离子交换膜,防止氢氧根离子进入阳极区;
(4)①已知:
ⅰ.4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) △H=-115.4kJ·mol-1
ⅱ.2HCl(g)+CuO(s)![]() CuCl2(s)+H2O(g) △H1=-120.4kJ·mol-1
CuCl2(s)+H2O(g) △H1=-120.4kJ·mol-1
所以根据盖斯定律ⅰ-2×ⅱ得:2CuCl2(s)+O2(g)=2CuO(s)+2Cl2(g) ΔH2=+125.4kJ·mol-1;
②氯化初期不含氯化氢气体,所以稀NaOH溶液(含少量酚酞)变红,后期含氯化氢与氢氧化钠中和碱性减弱,所以现象为溶液由红色变为无色;
③温度越高反应速率越快,所以氯化的时间缩短。


 H2↑+Cl2↑+2NaOH 离子交换膜法制碱技术,具有设备占地面积小、能连续生产、生产能力大、产品质量高、能适应电流波动、能耗低、污染小等优点,是氯碱工业发展的方向。
H2↑+Cl2↑+2NaOH 离子交换膜法制碱技术,具有设备占地面积小、能连续生产、生产能力大、产品质量高、能适应电流波动、能耗低、污染小等优点,是氯碱工业发展的方向。