中国在探索太空,开发深海,建设世界第一流的高铁、桥梁、码头,5G技术联通世界等方面取得了举世瞩目的成就,它们与化学有着密切联系,下列说法正确的是( )
A.中国天眼的“眼眶”是钢铁结成的圈梁,属于新型无机非金属材料
B.为打造生态文明建设,我国近年来大力发展核电、光电、风电、水电,电能属于一次能源
C.我国提出网络强国战略,光缆线路总长超过三千万公里,光缆的主要成分是二氧化硅
D.“神舟十一号”宇宙飞船返回舱外表面使用的高温结构陶瓷的主要成分是硅酸盐
C
【详解】
A.中国天眼的“眼眶”,索网结构是FAST主动反射面的主要支撑结构,不是新型无机非金属材料,故A错误;
B.电能不是一次能源,属于二次能源,故B错。
C.二氧化硅具有良好的光学特性,是制造光缆的主要原料,故C正确;
D.高温结构陶瓷包括氮化硅陶瓷,氮化硼陶瓷,碳化硼陶瓷,故D 错误;
故选:C
化学与生活密切相关,下列说法错误的是( )
A.推广使用新能源汽车可以减少尾气的排放
B.消毒液长时间敞开保存会增强其消毒效果
C.红葡萄酒中充入的少量SO2具有抗氧化的作用
D.作为医用呼吸机原材料之一的ABS树脂属于有机高分子材料
B
【详解】
A.推广使用新能源汽车可以减少化石能源的使用,从而减少二氧化碳等尾气的排放,故A正确;
B.消毒液长时间敞开保存会挥发、分解、变质,导致消毒效果减弱,故B错误;
C.二氧化硫具有还原性,红葡萄酒中充入的少量二氧化硫可以防止葡萄酒氧化变质,影响葡萄酒的口感,故C正确;
D.ABS树脂是丙烯晴、1,3—丁二烯和苯乙烯发生加聚反应的产物,属于有机高分子材料,故D正确;
故选B。
常温,下列各组离子一定能在指定溶液中大量共存的是( )
A.![]() =10-12的溶液中:
=10-12的溶液中:![]() 、Cu2+、
、Cu2+、![]() 、
、![]()
B.滴加KSCN溶液显红色的溶液中:![]() 、K+、Cl-、I-
、K+、Cl-、I-
C.0.1mol·L-1的NaHCO3溶液中:Fe3+、K+、Cl-、![]()
D.水电离产生的c(OH-)=10-12mol·L-1的溶液中:Na+、Al3+、Cl-、![]()
A
【详解】
A. 常温下,在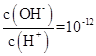 的溶液中,c(H+)=0.1mol·L-1,溶液显酸性,离子之间均不能发生反应,A项正确;
的溶液中,c(H+)=0.1mol·L-1,溶液显酸性,离子之间均不能发生反应,A项正确;
B. 滴加KSCN溶液显红色,说明溶液中存在Fe3+,Fe3+能够氧化I-,B项错误;
C. Fe3+与HCO3-发生相互促进的水解反应而不能大量共存,C项错误;
D. 由水电离的c(OH-)=10-12mol·L-1的溶液可能呈强酸性也可能呈强碱性,碱性溶液中Al3+不能大量存在,D项错误;
答案选A。
【点睛】
离子共存问题,侧重考查学生对离子反应发生的条件及其实质的理解能力,题型不难,需要注意的是,溶液题设中的限定条件。如无色透明,则常见的有颜色的离子如Cu2+、Fe3+、Fe2+、MnO4-、Cr2O72-、CrO42-等不符合题意;还有一些限定条件如:常温下与Al反应生成氢气的溶液时,该溶液可能为酸溶液,也可能为碱溶液。做题时只要多加留意,细心严谨,便可快速选出正确答案。还有一些限定条件如:常温下水电离出来的 H+和 OH-浓度为1×10-10,小于1×10-7时,该溶液可能为酸溶液,也可能为碱溶液。做题时只要多加留意,细心严谨,便可快速选出正确答案。
氯气是一种重要的工业原料,液氯储存区贴有的说明卡如下:
| 包装 | 钢瓶 |
| 储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
| 泄漏处理 | NaOH、NaHSO3溶液吸收 |
下列解释事实的方程式不正确的是
A.氯气用于自来水消毒:Cl2 + H2O![]() 2H+ + Cl-+ ClO-
2H+ + Cl-+ ClO-
B.电解饱和食盐水制取Cl2:2Cl- +2H2O![]() 2OH-+ H2↑+Cl2↑
2OH-+ H2↑+Cl2↑
C.浓氨水检验泄露的氯气,产生白烟:8NH3 + 3Cl2 === 6 NH4Cl + N2
D.氯气“泄漏处理”中NaHSO3溶液的作用:HSO3-+ Cl2 + H2O === SO42-+ 3H+ + 2Cl-
A
【解析】
A.HClO为弱酸,不能完全电离;
B.电解饱和食盐水生成氢气、氯气和氢氧化钠;
C.氯气具有强氧化性,可氧化氨气生成氮气;
D.氯气与亚硫酸钠发生氧化还原反应生成硫酸根离子。
【详解】
A. HClO为弱酸,不能完全电离,离子方程式为Cl2 + H2O![]() H+ + Cl-+ HClO,A项错误;
H+ + Cl-+ HClO,A项错误;
B. 电解饱和食盐水生成氢气、氯气和氢氧化钠,电解方程式为2Cl- +2H2O![]() 2OH-+ H2↑+Cl2↑,B项正确;
2OH-+ H2↑+Cl2↑,B项正确;
C. 氯气具有强氧化性,可氧化氨气生成氮气,同时生成氯化铵,方程式为8NH3 + 3Cl2 === 6NH4Cl + N2,C项正确;
D. 氯气与亚硫酸钠发生氧化还原反应生成硫酸根离子,反应的离子方程式为HSO3-+ Cl2 + H2O === SO42-+ 3H+ + 2Cl-,D项正确;
答案选A。
【点睛】
离子反应方程式的书写正误判断题是高频考点,涉及的知识面广,出题人经常设的陷阱有:不符合客观事实、电荷不守恒、原子不守恒以及反应物用量干扰等问题,如A选项是易错点,容易忽略次氯酸是弱电解质,而应该保留化学式。
已知H2O2易分解,反应式为2H2O2===2H2O+O2↑,FeS2的结构类似于Na2O2,是一种过硫化物,与酸反应时生成H2S2,H2S2易分解。实验室用稀硫酸与FeS2颗粒混合,则反应完毕后不可能生成的物质是
A.H2S B.S C.FeS D.FeSO4
C
【详解】
由题意知,FeS2颗粒与硫酸发生反应生成硫酸亚铁和过硫化氢,即FeS2+H2SO4=H2S2+FeSO4,H2S2类似于H2O2,易分解,H2S2发生分解反应生成H2S气体和单质S,即H2S2===H2S↑+S↓,则不可能生成的是FeS;答案为C。
本卷还有15题,登录并加入会员即可免费使用哦~

该作品由: 用户魅力天使分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。