现有常温下甲、乙、丙三种溶液,甲为0.1mol·L-1的NaOH溶液,乙为0.1mol·L-1的HCl溶液,丙为0.1mol·L-1的CH3COOH溶液,试回答下列问题:
(1)甲溶液的pH=___。
(2)丙溶液中存在的电离平衡为___(用电离平衡方程式表示)。
(3)常温下,用水稀释0.1mol·L-1的CH3COOH溶液,下列各量随水量的增加而增大的是___(填序号)。
①n(H+) ②c(H+) ③![]() ④c(OH-)
④c(OH-)
(4)甲、乙、丙三种溶液中由水电离出的c(OH-)最大的是___。
(5)某同学用甲溶液分别滴定20.00mL乙溶液和20.00mL丙溶液,得到如图所示的两条滴定曲线,则a=___。
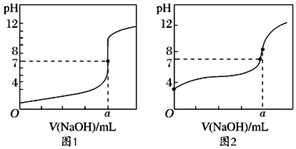
(6)图___(填1或2)表示NaOH溶液滴定CH3COOH溶液的过程。
(7)图2中a点对应的溶液pH=8,原因是___(用离子方程式表示)。
答案
13 CH3COOH![]() CH3COO-+H+,H2O
CH3COO-+H+,H2O![]() OH-+H+ ①④ 丙 20.00 2 CH3COO-+H2O
OH-+H+ ①④ 丙 20.00 2 CH3COO-+H2O![]() OH-+CH3COOH
OH-+CH3COOH
【详解】
(1) 氢氧化钠是强碱,所以溶液中氢离子浓度是1 x10-13mol/L,则溶液的pH=13;
(2)醋酸和水都是弱电解质,存在电离平衡,所以电离方程式分别是CH3COOH![]() CH3COO-+H+,H2O
CH3COO-+H+,H2O![]() OH-+H+;
OH-+H+;
(3) 常温下,用水稀释0.1mol·L-1的CH3COOH溶液,促进反应CH3COOH![]() CH3COO-+H+向右移动,所以n(H+)变大,但是体积增大的程度大于氢离子增加的程度,所以c(H+)变小,但是,常温下Kw不变,根据Kw= c(H+)· c(OH-)不变,所以c(OH-)变大;温度不变,
CH3COO-+H+向右移动,所以n(H+)变大,但是体积增大的程度大于氢离子增加的程度,所以c(H+)变小,但是,常温下Kw不变,根据Kw= c(H+)· c(OH-)不变,所以c(OH-)变大;温度不变,
Ka= ![]() 不变,而c(H+)变小,所以
不变,而c(H+)变小,所以![]() 变小;
变小;
(4)酸或碱都是抑制水的电离平衡的,且溶液中氢离子或OH-浓度越大,对水的电离的抑制程度越大。所以根据酸碱的浓度可知,甲、乙、两三种溶液中由水电离出的c(OH-)的大小关系为丙>甲=乙;
(5)盐酸和氢氧化钠恰好反应时,溶液显中性,所以根据酸碱的浓度以及盐酸的体积可知,消耗氢氧化钠溶液的体积是20.00ml,即a = 20.00ml;
(6) 图2中V(NaOH)=0时,pH大于1,可知0.1mol/L该溶液的pH大于1,所以图2应该表示甲溶液(NaOH溶液)滴定丙溶液(CH3COOH溶液)的曲线;
(7) 图2中a点对应的溶液pH=8,是因为此时刚好生成醋酸钠,醋酸根水解:CH3COO-+H2O![]() OH-+CH3COOH。
OH-+CH3COOH。

