新型冠状病毒来势汹汹,主要传播途径有飞沫传播、接触传播和气溶胶传播,但是它依然可防可控,采取有效的措施预防,戴口罩、勤洗手,给自己居住、生活的环境消毒,都是非常行之有效的方法。下列有关说法正确的是( )
A.云、烟、雾属于气溶胶,但它们不能发生丁达尔效应
B.使用酒精作为环境消毒剂时,酒精浓度越大,消毒效果越好
C.“84”消毒液与酒精混合使用可能会产生氯气中毒
D.生产“口罩”的无纺布材料是聚丙烯产品,属于天然高分子材料
C
【详解】
A.云、雾和烟均为胶体,且均为胶粒分散到气态分散剂中所得到的分散系,故均为气溶胶,它们都能发生丁达尔效应,故A错误;
B.浓度为75%的医用酒精消毒效果更好,并不是浓度越高消毒效果越好,故B错误;
C.“84”消毒液的主要成分为次氯酸钠,具有强氧化性,能氧化乙醇,自身被还原为氯气,故C正确;
D.从题中信息可看出生产无纺布的材料是合成材料,不是天然高分子材料,故D错误;
答案选C。
【点睛】
浓度为75%的医用酒精消毒效果最高,可以杀死病毒,在疫情期间可以使用医用酒精杀菌,但不是浓度越大越好。
明代宋应星《天工开物·杀青篇》中详细记载了古法制纸工艺。步骤可分为五步,“斩竹漂塘”、“煮楻足火”、“荡料入帘”、“覆帘压纸”、“透火焙干”。其中以发生化学反应为主的步骤是( )
A.煮楻足火 B.荡料入帘 C.覆帘压纸 D.透火焙干
A
【详解】
A.煮楻足火过程中发生了化学反应,属于化学变化,故A正确;B.将被打烂之竹料倒入水槽内,变化过程中无新物质生成属于物理变化,故B错误;C.捞好的纸膜一张张叠好,用木板压紧,上置重石,将水压出,变化过程中无新物质生成,故C错误;D.将湿纸逐张扬起,并加以焙干,变化过程中无新物质生成属于物理变化,故D错误;
故选A。
点睛:本题考查了古法制纸工艺,物质变化实质、注意变化过程中是否有新物质生成。解答本题的关键是理解造纸过程中的各步骤的本质。
NA是阿伏加德罗常数的值。下列说法正确的是
A.密闭容器中,2 mol NO 和 1 mol O2 反应后分子总数为 2NA
B.标准状况下,7.8 g 乙炔和苯的混合物中含 C—H 键数目为 0.6NA
C.将 1 mol NH3 通入足量水中,NH3·H2O、NH4+粒子数目之和为 NA
D.1 L 0.1 mol·L−1 FeCl3 溶液中含 Fe3+数目为 0.1NA
B
【详解】
A. 2 mol NO与1 mol O2发生反应2NO+O2=2NO2,生成2 mol NO2,因为存在化学平衡2NO2![]() N2O4,所以最终达到平衡时气体分子数小于2NA,A项错误;
N2O4,所以最终达到平衡时气体分子数小于2NA,A项错误;
B. 标准状况下,7.8 g乙炔(C2H2,0.3mol)中含C-H键0.6mol,7.8 g苯(C6H6,0.1mol) 中含C-H键0.6mol,所以二者的混合物中含C-H键数目为0.6NA,B项正确;
C. 将1 mol NH3通入足量水中,NH3、NH3 ·H2O、NH4+ 粒子数目之和为NA,C项错误;
D. 若不考虑Fe3+水解,1 L 0.1 mol·L−1 FeCl3 溶液中含 Fe3+数目为0.1NA,但Fe3+要发生水解,使Fe3+数目减少,D项错误;
答案选B。
安全是顺利进行实验及避免伤害的保障。下列实验操作正确但不是从实验安全角度考虑的是( )
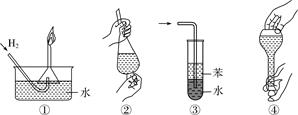
A.操作①:使用稍浸入液面下的倒扣漏斗检验氢气的纯度
B.操作②:使用CCl4萃取溴水中的溴时,振荡后需打开活塞使漏斗内气体放出
C.操作③:吸收氨或氯化氢气体并防止倒吸
D.操作④:用食指顶住瓶塞,另一只手托住瓶底,把瓶倒立,检查容量瓶是否漏水
D
【详解】
A.由于连通氢气发生装置的导管在液面以下,所以可以防止点燃不纯氢气时发生爆炸,该操作是从安全角度考虑,故A不符合题意;
B.打开活塞使漏斗内气体放出以防止分液漏斗内压强过大引起危险,该操作是从安全角度考虑,故B不符合题意;
C.水层在下层不能防止倒吸,应该使用四氯化碳,该操作不正确,故C不符合题意;
D.检查容量瓶是否漏水操作正确,但不是从实验安全角度考虑的,故D符合题意;
答案为D。
短周期主族元素 W、X、Y、Z 的原子序数依次增大,X 的质子数是 W 与 Z 的质子数之和的一半。m、n、p 是由这些元素组成的二元化合物,r 是元素 Y 的气体单质,n 为淡黄色粉末, 相关物质转化关系如图所示。室温下,0.01mol/L s 溶液 pH 为 12。下列说法误错的是

A.Z 是所在周期中原子半径最大的元素
B.简单离子半径大小:Y﹥Z﹥W
C.电负性:Y﹥X﹥W
D.n 中阴阳离子个数比为 1:1
D
【分析】
由已知条件可推出n为Na2O2、s为NaOH、r为O2、p为H2O,W、X、Y、Z分别为H、C、O、Na。
【详解】
A. Z是Na,同一周期,原子序数增大,原子半径减小,所以Z是所在周期中原子半径最大的元素,A项正确;
B. W、Y、Z对应的简单离子分别为:H+、O2-、Na+,电子层结构相同的离子,核电荷数越大,半径越小,可知简单离子半径大小:Y﹥Z﹥W,B项正确;
C. 非金属性:O﹥C﹥H,则电负性:O﹥C﹥H,C项正确;
D. n为Na2O2,1个Na2O2有两个钠离子和一个过氧根离子,则阴阳离子个数比为 2:1,D项错误;
答案选D。
【点睛】
考查原子结构和元素周期律的知识,结合实验现象和化学反应的关系推出元素的类别;再根据元素周期律的递变规律推出元素的性质;突破口在n,根据Na2O2的性质能与水和二氧化碳反应即可找到各元素名称。
本卷还有28题,登录并加入会员即可免费使用哦~

该作品由: 用户陈曦分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。