锌的配合物[Zn(NH3)4]2+、ZSM、[Zn(N2H4)2(N3)2] n等用途非常广泛。
(1)Zn2+基态核外电子排布式为________________________。
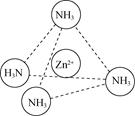
(2)Zn2+能与NH3形成配离子[Zn(NH3)4]2+。配体NH3分子属于________(填“极性分子”或“非极性分子”);在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在图中表示出[Zn(NH3)4]2+中Zn2+与N之间的化学键___________。
(3)ZSM是2-甲基咪唑和水杨酸与锌形成的配合物,2-甲基咪唑可通过下列反应制备:

①与CN-互为等电子体的分子是____________(填化学式,写两种)。
②2-甲基咪唑中碳原子杂化轨道类型为________;1 mol 2-甲基咪唑分子中含σ键和π键之比为________。
③乙二胺易溶于水的主要原因是_________________。
答案
[Ar]3d10(或1s22s22p63s23p63d10) 极性分子 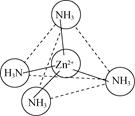 或
或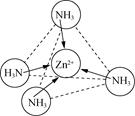 N2、CO sp2和sp3 6∶1 乙二胺分子与水分子能形成分子间氢键
N2、CO sp2和sp3 6∶1 乙二胺分子与水分子能形成分子间氢键
【分析】
(1)Zn原子失去最外层2个电子变为Zn2+,根据构造原理书写基态核外电子排布式;
(2)根据共价电子对的偏向判断NH3分子的极性;Zn2+具有空轨道,NH3的氮原子上有孤对电子;
(3)①根据等电子体含义结合CN-含有的电子数目分析;
②饱和碳原子采用sp3杂化,含有碳碳双键的碳原子采用sp2杂化,根据共价单键都是σ键,共价双键中一个是σ键,一个是π键分析;
③乙二胺与水分子之间形成氢键,增加了分子之间的作用。
【详解】
(1)Zn是30号元素,原子核外有30个电子,Zn原子失去最外层2个电子变为Zn2+,根据构造原理,可知基态Zn2+核外电子排布式为:1s22s22p63s23p63d10(或[Ar]3d10);
(2)NH3中的N-H键是极性共价键,由于吸引电子的能力N>H,使共用电子对偏向N原子一方,N原子带部分负电荷,H原子带部分正电荷,分子中正、负电荷重心不重合,因此NH3是极性分子;[Zn(NH3)4]2+是正四面体结构,Zn2+位于正四面体中心,N位于正四面体的顶点,由于Zn2+有空轨道,而NH3的N原子上有孤电子对,所以[Zn(NH3)4]2+中Zn2+与N之间以配位键结合,可表示为: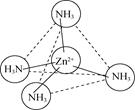 或
或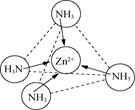 ;
;
(3)①等电子体含有的原子数相等,最外层电子数也相等,则与CN-互为等电子体的分子是CO、N2;
②2-甲基咪唑结构简式是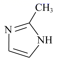 ,分子中含有两种碳原子,一种是结合4个其它原子或原子团的饱和碳原子,采用sp3杂化;另一种是C原子与C原子或C原子与N原子形成双键,这种碳原子没有达到结合其它原子的最大数目,是不饱和碳原子,采用sp2杂化;2-甲基咪唑分子式是C4H6N2,其中含有的单键都是σ键,共价双键中一个是σ键,一个是π键,则1个2-甲基咪唑中含有12个σ键,含有2个π键,则1 mol的2-甲基咪唑分子中含σ键和π键之比12:2=6:1;
,分子中含有两种碳原子,一种是结合4个其它原子或原子团的饱和碳原子,采用sp3杂化;另一种是C原子与C原子或C原子与N原子形成双键,这种碳原子没有达到结合其它原子的最大数目,是不饱和碳原子,采用sp2杂化;2-甲基咪唑分子式是C4H6N2,其中含有的单键都是σ键,共价双键中一个是σ键,一个是π键,则1个2-甲基咪唑中含有12个σ键,含有2个π键,则1 mol的2-甲基咪唑分子中含σ键和π键之比12:2=6:1;
③乙二胺与水之间易形成氢键,增加了分子之间的吸引力,使得乙二胺易溶于水中。
【点睛】
本题考查了原子核外电子排布、原子的杂化、等电子体、共价键的表示等知识。掌握物质结构理论及原子结构与物质性质的关系是本题解答的关键。


 等。
等。  、金刚石等。
、金刚石等。  等。
等。  等。
等。  等。
等。  等。
等。  等。
等。  等原子晶体。
等原子晶体。  等)。
等)。