向![]() 的密闭容器中充入
的密闭容器中充入![]() 和
和![]() ,发生反应
,发生反应![]()
![]() 。
。![]() 后,测得不同温度下
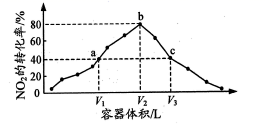
后,测得不同温度下![]() 转化率如下图所示。下列说法正确的是
转化率如下图所示。下列说法正确的是

A.400℃时,反应在![]() 内的平均速率
内的平均速率![]()
B.b点所示条件下延长反应时间,![]() 转化率将大于42%
转化率将大于42%
C.c、d两点,反应的化学平衡常数相等
D.600℃时达平衡后,保持其他条件不变,再充入![]() 和
和![]() ,达新平衡时
,达新平衡时![]() 转化率小于35%
转化率小于35%
答案
BD
【解析】
A.由图可知,400℃时二氧化氮的转化率为85%,则反应的二氧化氮的物质的量为![]() ,反应在
,反应在![]() 内的平均速率
内的平均速率![]() ,A错误;
,A错误;
B.b点未达到平衡状态,反应向正向进行,故所示条件下延长反应时间,![]() 转化率将大于42%,B正确;
转化率将大于42%,B正确;
C.平衡常数仅与温度有关,c、d两点温度不同故平衡常数不相等,C错误;
D.再充入![]() 和
和![]() ,等效在原平衡基础上增大压强,平衡逆向移动,达新平衡时
,等效在原平衡基础上增大压强,平衡逆向移动,达新平衡时![]() 转化率小于35%,D正确;
转化率小于35%,D正确;
答案选BD。



 也相同,但各物质的浓度、物质的量、混合气体的密度、体系的压强、气体的反应速率等均不相同但成比例。
也相同,但各物质的浓度、物质的量、混合气体的密度、体系的压强、气体的反应速率等均不相同但成比例。