等效平衡规律:
(1)在恒温、恒容条件下,对于反应前后气体分子数改变的可逆反应,只改变起始时加入物质的物质的量,如果按化学方程式的化学计量关系转化为化学方程式中同一半边的物质,其物质的量与对应组分的起始加入量相同,则建立的化学平衡是等效的

恒温、恒容时,I、Ⅱ、Ⅲ这三种情况下达到的平衡完全等效。IV与I、Ⅱ、Ⅲ不等效。
(2)在恒温、恒容条件下,对于反应前后气体分子数不变的可逆反应,改变起始时加入物质的物质的量,如果按化学方程式的化学计量关系转化为化学方程式同一半边的物质,其物质的量比与对成组分的起始加入量比相同,则建立的化学平衡是等效的。

I、Ⅱ、Ⅲ形成等效平衡,此处等效的含义是各物质的体积分数相同,同时,混合气体的平均摩尔质量

也相同,但各物质的浓度、物质的量、混合气体的密度、体系的压强、气体的反应速率等均不相同但成比例。
(3)在恒温、恒压条件下,改变起始时加入物质的物质的量,如果按化学计量数换算成化学方程式同一半边的物质,其物质的量之比与对应组分的起始加入量之比相同,则建立的化学平衡等效。

I、Ⅱ、Ⅲ、Ⅳ形成等效平衡。说明等效平衡分析方法:“一边倒”——按化学计量关系将生成(反应)物全部转化为反应(生成) 物后再看是否相同或成比例。
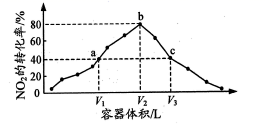
![]() 2Z(g),反应达到平衡时,混合气体中X和Y的物质的量之和与Z的物质的量相等,则X的转化率为( )
2Z(g),反应达到平衡时,混合气体中X和Y的物质的量之和与Z的物质的量相等,则X的转化率为( )![]() 2Z(g)可知,本题考查化学平衡时转化率,运用转化率等于变化量除以投入量分析。
2Z(g)可知,本题考查化学平衡时转化率,运用转化率等于变化量除以投入量分析。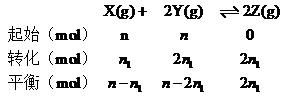 ,n-n1+n-2n1=2n1,n1=
,n-n1+n-2n1=2n1,n1=![]() ,X的转化率为
,X的转化率为 ,A项正确,
,A项正确,


 也相同,但各物质的浓度、物质的量、混合气体的密度、体系的压强、气体的反应速率等均不相同但成比例。
也相同,但各物质的浓度、物质的量、混合气体的密度、体系的压强、气体的反应速率等均不相同但成比例。