碲是当代高科技材料不可缺少的重要组成元素。以铋碲矿(主要含Te、Bi、Si、S等元素)为原料生产精碲的工艺流程如下:

已知:TeO2是两性氧化物,微溶于水.回答下列问题:
(1)浸出液中碲以TeO2+存在,步骤①加入Na2SO3进行还原,反应的离子方程式为________。Na2SO3的实际用量比理论用量偏多,其主要原因是________。
(2)王水是由约3体积浓盐酸和约1体积浓硝酸配制而成。在实验室中配制王水所用的玻璃仪器除玻璃棒外还有________。王水溶解粗碲时,加入的碲粉与生成的NO的物质的量之比为________。
(3)粗碲中仍含有硅元素,净化时加入CaCl2溶液可以除去硅元素,硅元素将以________(填化学式)形式被除去。
(4)步骤③,将Na2TeO3转化为TeO2,反应的离子方程式是________。
(5)电解时,精碲在______极析出,电解产物中可循环使用的是________。
(1). TeO2++2SO32-+H2O=Te↓+2SO42-+2H+ (2). Na2SO3与盐酸反应产生SO2 (或与浸出液中其他氧化性物质反应) (3). 量筒和烧杯 (4). 3:4 (5). CaSiO3 (6). TeO32-+2H+=TeO2↓+H2O (7). 阴 (8). NaOH
【解析】
(1) 碲以TeO2+存在,步骤①加入Na2SO3进行还原,发生氧化还原反应生成粗碲、硫酸根离子,并用电荷守恒配平;浸泡时,用HCl、NaClO3过量,加入亚硫酸钠时会发生化学反应;
(2) 实验室配制王水时,量取盐酸、硝酸的体积用量筒,配制时在烧杯中,搅拌使用玻璃棒;王水溶解粗碲时,反应的离子方程式为3Te+4H++4NO3-=3TeO2+4NO↑+2 H2O;
(3)粗碲中仍含有硅元素,且以硅酸根离子的形式存在;
(4)步骤③,通过调节pH,将Na2TeO3转化为TeO2;
(5) TeO2是两性氧化物,加入NaOH时,以TeO32-形式存在,电解时,Te的化合价降低,得电子生成氢氧根离子、Te。(1) 碲以TeO2+存在,步骤①加入Na2SO3进行还原,发生氧化还原反应生成粗碲、硫酸根离子,并用电荷守恒配平,离子方程式为TeO2++2SO32-+H2O=Te↓+2SO42-+2H+;浸泡时,用HCl、NaClO3过量,加入亚硫酸钠时会发生化学反应,导致Na2SO3的实际用量比理论用量偏多;
(2) 实验室配制王水时,量取盐酸、硝酸的体积用量筒,配制时在烧杯中,搅拌使用玻璃棒;王水溶解粗碲时,反应的离子方程式为3Te+4H++4NO3-=3TeO2+4NO↑+2 H2O,碲粉与生成的NO的物质的量之比为3:4;
(3)粗碲中仍含有硅元素,且以硅酸根离子的形式存在,加入CaCl2溶液时可生成硅酸钙沉淀;
(4)步骤③,通过调节pH,将Na2TeO3转化为TeO2,反应的离子方程式为TeO32-+2H+=TeO2↓+H2O;
(5) TeO2是两性氧化物,加入NaOH时,以TeO32-形式存在,电解时,Te的化合价降低,得电子,则在阴极产生;同时生成氢氧根离子,则可循环使用物质为NaOH。
二甲醚被称为“21世纪的清洁燃料”。利用甲醇脱水可制得二甲醚。反应方程式如下:2CH3OH(g)≒CH3OCH3(g)+H2O(g) ΔH1
(1) 二甲醚亦可通过合成气反应制得,相关热化学方程式如下:2H2(g)+CO(g)≒CH3OH(g) ΔH2
CO(g)+H2O(g)≒CO2(g)+H2(g) ΔH3 3H2(g)+3CO(g)≒CH3OCH3(g) +CO2(g) ΔH4
则ΔH1=__________________(用含有ΔH2、ΔH3、ΔH4的关系式表示).
(2)经查阅资料,上述甲醇脱水反应平衡常数Kp的计算式为lnKp= - 2.205+(2708.6137/T) (Kp为以分压表示的平衡常数,T为热力学温度),且催化剂吸附H2O(g)的量会受压强影响,从而进步影响催化效率。
①在一定温度范围内,随温度升高,CH3OH(g)脱水转化为CH3OCH3(g)的倾向__________ (填“增大”、“不变”或“减小”),ΔH4________2ΔH2+ΔH3 (填“>”、<”或“=”)。
| 物质 | CH3OH | CH3OCH3 | H2O |
| 分压/MPa | 0.50 | 0 | 0.50 |
②某温度下(此时Kp=100),在密闭容器中加入一定量CH3OH,某时刻测得各组分的压如下:
此时正、逆反应速率的大小:V正____V逆(填“>”、“<”或“=”)。
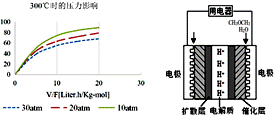
③200℃时,在密闭容器中加入一定量CH3OH,反应到达平衡状态时,体系中CH3OCH3(g)的物质的量分数为__________(填序号).
A.< 1/3 B.1/3 C.1/3~1/2 D.1/2 E.> 1/2
④300℃时,使CH3OH(g)以一定流速通过催化剂,V/F(按原料流率的催化剂量)、压强对甲醇转化率影响如图1所示。请简述在上述条件下,压强对甲醇转化率影响的规律,并解释变化原因__________。
(3)直接二甲醚燃料电池有望大规模商业化应用,工作原理如图2所示。
①负极的电极反应式为__________。
②现利用该电池电解CuC12溶液,当消耗2.3g二甲醚时,电解所得铜的质量为_________g(设电池的能量利用率为50%)。
(1). ΔH 4-2ΔH2 -ΔH 3 (2). 减小 (3). < (4). > (5). C (6). 规律:其他条件不变时,随压强(压力)增大,甲醇转化率降低,原因:压强增大,催化剂吸附水分子的量增多,催化效率降低,相同时间里转化量减少,甲醇转化率降低。 (说明:如规律写错,解释不给分) (7). CH3OCH3—12e-+3H2O=2CO2+12H+ (8). 9.6
【解析】
(1)根据盖斯定律计算;
(2)①lnKp= - 2.205+(2708.6137/T),升高温度lnKp减小,则Kp减小,平衡逆向移动;
②Qp与Kp的关系判断;
③根据lnKp= - 2.205+(2708.6137/T),计算Kp,若催化剂对水蒸气无影响时和催化剂对水蒸气有影响计算P(CH3OCH3)及 CH3OCH3(g)的物质的量分数;
④根据图像可知,温度相同时,随压强的增大,甲醇转化率降低,压强增大,催化剂吸附H2O(g)的量会受压强影响;
(3)①二甲醚燃料电池中,二甲醚失电子,化合价升高,作电池的负极,电解质溶液显酸性,则生成二氧化碳和氢离子;
②根据转移电子数目守恒计算。(1)①2H2(g)+CO(g)⇌CH3OH(g) ΔH2 ②CO(g)+H2O(g) ⇌CO2(g)+H2(g) ΔH3 ③3H2(g)+3CO(g) ⇌CH3OCH3(g) +CO2(g) ΔH4,根据盖斯定律,③-②-2①,可得2CH3OH(g) ⇌CH3OCH3(g)+H2O(g) ΔH1=ΔH4-2ΔH2 -ΔH 3;
(2)①lnKp= - 2.205+(2708.6137/T),升高温度lnKp减小,则Kp减小,平衡逆向移动,转化成CH3OCH3(g)的倾向减小;ΔH1<0,则ΔH4<2ΔH2 -ΔH 3;
②Qp= ![]() =
=![]() =1<100,平衡正向进行,则V正>V逆;
=1<100,平衡正向进行,则V正>V逆;
③若初始投入的甲醇完全反应时,生成等量的二甲醚和水,二甲醚占据的物质的量分数为![]() ;lnKp= - 2.205+(2708.6137/T),温度为200℃时,Kp=33.78,若催化剂对水蒸气无影响时,且P(CH3OH)=1,则P(CH3OCH3)=5.8,压强之比等于物质的量之比,CH3OCH3(g)的物质的量分数为
;lnKp= - 2.205+(2708.6137/T),温度为200℃时,Kp=33.78,若催化剂对水蒸气无影响时,且P(CH3OH)=1,则P(CH3OCH3)=5.8,压强之比等于物质的量之比,CH3OCH3(g)的物质的量分数为![]() =0.46,答案为C;
=0.46,答案为C;
④根据图像可知,温度相同时,随压强的增大,甲醇转化率降低,压强增大,催化剂吸附H2O(g)的量会受压强影响,导致催化剂吸附水分子的量增多,催化效率降低,相同时间里转化量减少,甲醇转化率降低。
(3)①二甲醚燃料电池中,二甲醚失电子,化合价升高,作电池的负极,电解质溶液显酸性,则生成二氧化碳和氢离子,电极反应式为CH3OCH3-12e-+3H2O=2CO2+12H+;
②消耗2.3g二甲醚时,转移电子的物质的量为0.05×12=0.6mol,铜离子得电子生成单质铜,生成![]() =0.15molCu,即9.6g。
=0.15molCu,即9.6g。
硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]比FeSO4稳定,不易被氧气氧化,常用于代替FeSO4作分析试剂。某小组尝试制备少量(NH4)2Fe(SO4)2·6H2O并探究其分解产物。

I.制备硫酸亚铁铵晶体的流程如下:
(1)铁屑溶于稀硫酸的过程中,适当加热的目的是_________。
(2)将滤液转移到_________中,迅速加入饱和硫酸铵溶液,直接加热蒸发混合溶液,观察到_________停止加热。蒸发过程保持溶液呈较强酸性的原因是_________。
Ⅱ.查阅资料可知,硫酸亚铁铵晶体受热主要发生反应:
____(NH4)2Fe(SO4)2·6H2O=____Fe2O3+____SO2↑+____NH3↑+____N2↑+____H2O
但伴有副反应发生,生成少量SO3和O2。设计以下实验探究部分分解产物:

(3)配平上述分解反应的方程式。
(4)加热过程,A中固体逐渐变为_______色。
(5)B中迅速产生少量白色沉淀,反应的离子方程式为______。
(6)C的作用是_________。
(7)D中集气瓶能收集到O2,____ (填“能”或“不能”)用带火星木条检验。
(8)上述反应结来后,继续证明分解产物中含有NH3的方法是_________。
(1). 加快反应速率 (2). 蒸发皿 (3). 有晶膜出现(或大量固体出现时) (4). 防止硫酸亚铁水解 (5). 2 (6). 1 (7). 4 (8). 2 (9). 1 (10). 5 (11). 红棕 (12). Ba2++SO3+H2O=BaSO4↓+2H+(说明:分步写也给分2Ba2++2SO2+O2+2H2O=2BaSO4↓+4H+也给分) (13). 检验产物中是否含有SO2 (14). 不能 (15). 取B中少量溶液于试管中,滴加少量NaOH溶液并加热,能产生使湿润红色石蕊试纸变蓝的气体
【解析】
I.(1) 适当加热使溶液温度升高,可加快反应速率;
(2)加入饱和的硫酸铵溶液后直接加热蒸发,加热溶液至有晶膜出现(或大量固体出现时),停止加热;溶液一直保持强酸性防止硫酸亚铁水解;
Ⅱ.(3)根据化合价升降法配平;
(4) 加热过程,A逐渐变为氧化铁;
(5) B为酸性溶液,二氧化硫、氧气与氯化钡反应生成少量硫酸钡白色沉淀;
(6)C中品红溶液可以二氧化硫反应,导致溶液褪色;
(7)D中集气瓶能收集到SO2和少量的O2;
(8)溶液B显酸性,氨气能够在此装置中被吸收,检验B中是否含有铵根离子即可。I.(1) 适当加热使溶液温度升高,可加快反应速率;
(2)加入饱和的硫酸铵溶液后直接加热蒸发,则滤液转移到蒸发皿中;加热溶液至有晶膜出现(或大量固体出现时),停止加热,利用余热进行蒸发结晶;为防止硫酸亚铁水解,溶液一直保持强酸性;
Ⅱ.(3)反应中Fe的化合价由+2变为+3,N的化合价由-3变为0,S的化合价由+6变为+4,根据原子守恒,硫酸亚铁铵的系数为2,SO2的系数为4,则电子转移总数为8,Fe得到2个电子,产生1个氮气,得到6个电子,则系数分别为2、1、4、2、1、5;
(4) 加热过程,A逐渐变为氧化铁,固体为红棕色;
(5) B为酸性溶液,二氧化硫、氧气与氯化钡反应生成少量硫酸钡白色沉淀,离子方程式为2Ba2++2SO2+O2+2H2O=2BaSO4↓+4H+;
(6)C中品红溶液可与二氧化硫反应,导致溶液褪色,则可检验二氧化硫的存在;
(7)D中集气瓶能收集到SO2和少量的O2,不能使带火星的木条燃烧;
(8)溶液B显酸性,氨气能够在此装置中被吸收,检验B中是否含有铵根离子即可,方法为取B中少量溶液于试管中,滴加少量NaOH溶液并加热,能产生使湿润红色石蕊试纸变蓝的气体。
海洋是资源的宝库,醢藏着丰富的化学元素,如氯、溴、碘等,海洋资源的综合利用具有非常广阔的前景。
(1)下列说法正确的是_________。
a.AgCl、AgBr、AgI的颜色依次变深 b.F、Cl、Br、I的非金属性依次增强
c.HF、HCl、HBr、HI的还原性的依次增强 d.F2、Cl2、Br2、I2与H2化合由难变易
(2)实验室从海藻灰中提取少量碘的流程如下图:
![]()
①氧化时,可以加入MnO2在酸性条件下进行氧化,反应的离子方程式为:_________。
②上述步骤①②③分离操作分别为过滤、_________、_________。
(3)从海水提取的粗盐中含有Mg2+、Fe2+、Ca2+和SO42—等杂质,“除杂”所需试剂有:①过量的NaOH溶液②过量的Na2CO3溶液③适量的盐酸④过量的BaCl2溶液.试剂的添加顺序为_________。
![]() 使Ca2+完全沉淀,溶液中c(CO32—)应不小于_________mol/L。[已知Ksp(CaCO3)=2.9×10-9,离子浓度小于1×10-5mol/L视为完全沉淀]
使Ca2+完全沉淀,溶液中c(CO32—)应不小于_________mol/L。[已知Ksp(CaCO3)=2.9×10-9,离子浓度小于1×10-5mol/L视为完全沉淀]
(4)目前,利用食盐制取纯碱主要有“氨碱法”和“联合制碱法”两种工艺
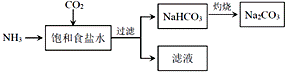
①能析出 NaHCO3的原因是_________。
②“氨碱法”是在滤液中加入_________产生NH3,循环使用,但产生大量的度弃物CaCl2;“联合制碱法“是在滤液中继续通入NH3,并加入NaCl粉末以制得更多的副产物_________。
③常温下,向饱和食盐水中通入NH3和CO2,当(HCO3—)=c(NH4+)时,溶液的pH_____7 (填“>”、“<”或“=”)。
(1). ac (2). MnO2+2I—+4H+=Mn2++I2+2H2O (3). 分液 (4). 蒸馏 (5). ①④②③(或④②①③或④①②③) (6). 2.9×10-44) (7). NaHCO3的溶解度最小 (8). CaO[或Ca(OH)2] (9). NH4Cl (10). 小于
【解析】
(1) a.AgCl、AgBr、AgI的颜色分别为白色、浅黄色、黄色,依次变深;
b.F、Cl、Br、I的非金属性依次减弱,金属性依次增强;
c.HF、HCl、HBr、HI的稳定性依次减弱,即还原性的依次增强;
d.F2、Cl2、Br2、I2与H2化合由易变难;
(2)①氧化时,在酸性条件下MnO2与碘离子反应生成二价锰离子、碘单质和水;
②步骤①为固液分离,方法为过滤;②为萃取后分液;③蒸发掉有机物生成晶态碘;
(3) 除Mg2+、Fe2+用NaOH,除Ca2+用碳酸钠,除SO42-用氯化钡溶液,但会引入钡离子,除钡离子也用碳酸钠,则除硫酸根离子在除钙离子之前,过滤后再加盐酸除去碳酸根离子和氢氧根离子;根据Ksp(CaCO3)计算;
(4) ①NaHCO3的溶解度小于碳酸钠的;
②“氨碱法”滤液中的主要成分为氯化铵;
③根据溶液呈电中性计算、判断。(1) a.AgCl、AgBr、AgI的颜色分别为白色、浅黄色、黄色,依次变深,a正确;
b.F、Cl、Br、I的非金属性依次减弱,金属性依次增强,b错误;
c.HF、HCl、HBr、HI的稳定性依次减弱,即还原性的依次增强,c正确;
d.F2、Cl2、Br2、I2与H2化合由易变难,d错误;
答案为ac;
(2)①氧化时,在酸性条件下MnO2与碘离子反应生成二价锰离子、碘单质和水,离子方程式为MnO2+2I-+4H+=Mn2++I2+2H2O;
②步骤①为固液分离,方法为过滤;②为萃取后分液;③蒸发掉有机物生成晶态碘;
(3) 除Mg2+、Fe2+用NaOH,除Ca2+用碳酸钠,除SO42-用氯化钡溶液,但会引入钡离子,除钡离子也用碳酸钠,则除硫酸根离子在除钙离子之前,过滤后再加盐酸除去碳酸根离子和氢氧根离子,添加顺序为①④②③(或④②①③或④①②③);Ksp(CaCO3)=c(Ca2+)×c(CO32-)=2.9×10-9,则c(CO32-)=2.9×10-4mol/L;
(4) ①NaHCO3的溶解度小于碳酸钠的,则饱和碳酸钠溶液中通二氧化碳和氨气时能析出碳酸氢钠;
②“氨碱法”滤液中的主要成分为氯化铵,加入CaO[或Ca(OH)2]时可产生氨气;在滤液中继续通入NH3,并加入NaCl粉末能得到更多的氯化铵;
③根据溶液呈电中性,c(Na+)+c(H+)+c(NH4+)=c(Cl-)+c(OH-)+c(HCO3-)+2c(CO32-),c(Na+)=c(Cl-),c(NH4+)=c(HCO3-),则c(H+)= c(OH-)+2c(CO32-),溶液呈酸性,pH<7。
【点睛】非金属的非金属性越强,其氢化物越稳定,失电子能力越弱。
常温下,将1.0L X mol/L CH3COOH溶液与0.1mol NaOH固体混合充分反应,再向该混合溶液中通人HCl气体或加入NaOH固体(忽略体积和温度变化),溶液pH随通入(或加入)物质的物质的量的变化如图所示。下列说法正确的是

A. X<0.1
B. b→a过程中,水的电离程度逐渐增大
C. Ka (CH3COOH) =10-8/(X-0.1)
D. b→c过程中,c(CH3COOH)/c(CH3COO) 逐渐变小
B
【解析】
根据图像可知,b点溶液显酸性,则为CH3COOH、CH3COONa的混合液。A. b点溶液呈酸性,酸过量,则X>0.1mol/L,A错误;
B. b→a过程中,加入NaOH溶液,消耗过量的乙酸,生成乙酸钠,则水的电离程度逐渐增大,B正确;
C. a点时,向乙酸溶液中加入0.2molNaOH,溶液中c(H+)=10-7mol/L,c(CH3COO-)=0.2mol/L,c(CH3COOH)=(X-0.2)mol/L,则Ka (CH3COOH) =![]() ,C错误;
,C错误;
D. b→c过程中,溶液中酸性增强,c(CH3COOH)增大,c(CH3COO) 减小,而![]() 逐渐变大,D错误;
逐渐变大,D错误;
答案为B。
【点睛】b点为CH3COOH、CH3COONa的混合液,加入NaOH时,生成更多的CH3COONa,促进水的电离。
本卷还有17题,登录并加入会员即可免费使用哦~

该作品由: 用户林晓龙分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。