羟基乙酸钠易溶于热水,微溶于冷水,不溶于醇、醚等有机溶剂。制备少量羟基乙酸钠的反应为
![]()
实验步骤如下:
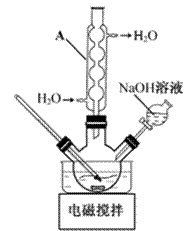
步骤1:如图所示装置的反应瓶中,加入40g氯乙酸、50mL水,搅拌。逐步加入40%NaOH溶液,在95℃继续搅拌反应2小时,反应过程中控制pH约为9。
步骤2:蒸出部分水至液面有薄膜,加少量热水,趁热过滤。滤液冷却至15℃,过滤得粗产品。
步骤3:粗产品溶解于适量热水中,加活性炭脱色,分离掉活性炭。
步骤4:将去除活性炭后的溶液加到适量乙醇中,冷却至15℃以下,结晶、过滤、干燥,得羟基乙酸钠。
(1)步骤1中,如图所示的装置中仪器A的名称是___________;逐步加入NaOH溶液的目的是____________。
(2)步骤2中,蒸馏烧瓶中加入沸石或碎瓷片的目的是_______________。
(3)步骤3中,粗产品溶解于过量水会导致产率__________(填“增大”或“减小”);去除活性炭的操作名称是_______________。
(4)步骤4中,将去除活性炭后的溶液加到适量乙醇中的目的是_______________。
(1). (回流)冷凝管 (2). 防止升温太快、控制反应体系pH (3). 防止暴沸 (4). 减小 (5). 趁热过滤 (6). 提高羟基乙酸钠的析出量(产率)
【解析】
【分析】
制备少量羟基乙酸钠的反应为![]() ,根据羟基乙酸钠易溶于热水,粗产品溶解于适量热水中,加活性炭脱色,分离掉活性炭,趁热过滤,根据羟基乙酸钠不溶于醇,将去除活性炭后的溶液加到适量乙醇中,冷却至15℃以下,结晶、过滤、干燥,得羟基乙酸钠。
,根据羟基乙酸钠易溶于热水,粗产品溶解于适量热水中,加活性炭脱色,分离掉活性炭,趁热过滤,根据羟基乙酸钠不溶于醇,将去除活性炭后的溶液加到适量乙醇中,冷却至15℃以下,结晶、过滤、干燥,得羟基乙酸钠。
【详解】(1)根据图中仪器得出仪器A的名称为冷凝管,根据题中信息可知制备羟基乙酸钠的反应为放热反应,逐步加入NaOH溶液的目的是防止升温太快,同时控制反应体系的pH;故答案为:(回流)冷凝管;防止升温太快,控制反应体系的pH。
(2步骤2中烧瓶中加入沸石或碎瓷片的目的是防止暴沸;故答案为:防止暴沸。
(3)粗产品溶于过量水,导致在水中溶解过多,得到的产物减少,因此导致产率减小;由于产品易溶于热水,微溶于冷水,因此去除活性炭的操作名称是趁热过滤;故答案为:减少;趁热过滤。
(4)根据信息,产品不溶于乙醇、乙醚等有机溶剂中,因此步骤4中,将去除活性炭后的溶液加到适量乙醇中的目的是降低产品的溶解度,提高羟基乙酸钠的析出量(产量);故答案为:提高羟基乙酸钠的析出量(产量)。
【点睛】化学实验是常考题型,主要考查实验仪器、实验操作、对新的信息知识的理解。
实验室由炼钢污泥(简称铁泥,主要成份为铁的氧化物)制备软磁性材料α-Fe2O3。
其主要实验流程如下:
![]()
(1)酸浸:用一定浓度的H2SO4溶液浸取铁泥中的铁元素。若其他条件不变,实验中采取下列措施能提高铁元素浸出率的有___________(填序号)。
A.适当升高酸浸温度
B.适当加快搅拌速度
C.适当缩短酸浸时间
(2)还原:向“酸浸”后的滤液中加入过量铁粉,使Fe3+完全转化为Fe2+。“还原”过程中除生成Fe2+外,还会生成___________(填化学式);检验Fe3+是否还原完全的实验操作是______________。
(3)除杂:向“还原”后的滤液中加入NH4F溶液,使Ca2+转化为CaF2沉淀除去。若溶液的pH偏低、将会导致CaF2沉淀不完全,其原因是___________[![]() ,
,![]() ]。
]。
(4)沉铁:将提纯后的FeSO4溶液与氨水-NH4HCO3混合溶液反应,生成FeCO3沉淀。
①生成FeCO3沉淀的离子方程式为____________。
②设计以FeSO4溶液、氨水- NH4HCO3混合溶液为原料,制备FeCO3的实验方案: 。
【FeCO3沉淀需“洗涤完全”,Fe(OH)2开始沉淀的pH=6.5】。
(1). AB (2). H2 (3). 取少量清液,向其中滴加几滴KSCN溶液,观察溶液颜色是否呈血红色 (4). pH偏低形成HF,导致溶液中F-浓度减小,CaF2沉淀不完全 (5). ![]() 或
或![]() (6). 在搅拌下向FeSO4溶液中缓慢加入氨水-NH4HCO3混合溶液,控制溶液pH不大于6.5;静置后过滤,所得沉淀用蒸馏水洗涤2~3次;取最后一次洗涤后的滤液,滴加盐酸酸化的BaCl2溶液,不出现白色沉淀
(6). 在搅拌下向FeSO4溶液中缓慢加入氨水-NH4HCO3混合溶液,控制溶液pH不大于6.5;静置后过滤,所得沉淀用蒸馏水洗涤2~3次;取最后一次洗涤后的滤液,滴加盐酸酸化的BaCl2溶液,不出现白色沉淀
【解析】
【分析】
铁泥的主要成份为铁的氧化物,铁泥用H2SO4溶液“酸浸”得到相应硫酸盐溶液,向“酸浸”后的滤液中加入过量铁粉将Fe3+还原为Fe2+;向“还原”后的滤液中加入NH4F使Ca2+转化为CaF2沉淀而除去;然后进行“沉铁”生成FeCO3,将FeCO3沉淀经过系列操作制得α—Fe2O3;据此分析作答。
【详解】(1)A.适当升高酸浸温度,加快酸浸速率,能提高铁元素的浸出率,A选;
B.适当加快搅拌速率,增大铁泥与硫酸溶液的接触,加快酸浸速率,能提高铁元素的浸出率,B选;
C.适当缩短酸浸时间,铁元素的浸出率会降低,C不选;
答案选AB。
(2)为了提高铁元素的浸出率,“酸浸”过程中硫酸溶液要适当过量,故向“酸浸”后的滤液中加入过量的铁粉发生的反应有:Fe+2Fe3+=3Fe2+、Fe+2H+=Fe2++H2↑,“还原”过程中除生成Fe2+外,还有H2生成;通常用KSCN溶液检验Fe3+,故检验Fe3+是否还原完全的实验操作是:取少量清液,向其中滴加几滴KSCN溶液,观察溶液颜色是否呈血红色,若不呈血红色,则Fe3+还原完全,若溶液呈血红色,则Fe3+没有还原完全,故答案为:H2,取少量清液,向其中滴加几滴KSCN溶液,观察溶液颜色是否呈血红色。
(3)向“还原”后的滤液中加入NH4F溶液,使Ca2+转化为CaF2沉淀,Ksp(CaF2)=c(Ca2+)·c2(F-),当Ca2+完全沉淀(某离子浓度小于1×10-5mol/L表明该离子沉淀完全)时,溶液中c(F-)至少为![]() mol/L=
mol/L=![]() ×10-2mol/L;若溶液的pH偏低,即溶液中H+浓度较大,H+与F-形成弱酸HF,导致溶液中c(F-)减小,CaF2沉淀不完全,故答案为:pH偏低形成HF,导致溶液中F-浓度减小,CaF2沉淀不完全。
×10-2mol/L;若溶液的pH偏低,即溶液中H+浓度较大,H+与F-形成弱酸HF,导致溶液中c(F-)减小,CaF2沉淀不完全,故答案为:pH偏低形成HF,导致溶液中F-浓度减小,CaF2沉淀不完全。
(4)①将提纯后的FeSO4溶液与氨水—NH4HCO3混合溶液反应生成FeCO3沉淀,生成FeCO3的化学方程式为FeSO4+NH3·H2O+NH4HCO3=FeCO3↓+(NH4)2SO4+H2O[或FeSO4+NH3+NH4HCO3=FeCO3↓+(NH4)2SO4],离子方程式为Fe2++![]() +NH3·H2O=FeCO3↓+
+NH3·H2O=FeCO3↓+![]() +H2O(或Fe2++
+H2O(或Fe2++![]() +NH3=FeCO3↓+
+NH3=FeCO3↓+![]() ),答案为:Fe2++
),答案为:Fe2++![]() +NH3·H2O=FeCO3↓+
+NH3·H2O=FeCO3↓+![]() +H2O(或Fe2++
+H2O(或Fe2++![]() +NH3=FeCO3↓+
+NH3=FeCO3↓+![]() )。
)。
②根据题意Fe(OH)2开始沉淀的pH=6.5,为防止产生Fe(OH)2沉淀,所以将FeSO4溶液与氨水—NH4HCO3混合溶液反应制备FeCO3沉淀的过程中要控制溶液的pH不大于6.5;FeCO3沉淀需“洗涤完全”,所以设计的实验方案中要用盐酸酸化的BaCl2溶液检验最后的洗涤液中不含![]() ;则设计的实验方案为:在搅拌下向FeSO4溶液中缓慢加入氨水—NH4HCO3混合溶液,控制溶液pH不大于6.5;静置后过滤,所得沉淀用蒸馏水洗涤2~3次;取最后一次洗涤后的滤液,滴加盐酸酸化的BaCl2溶液,不出现白色沉淀,故答案为:在搅拌下向FeSO4溶液中缓慢加入氨水—NH4HCO3混合溶液,控制溶液pH不大于6.5;静置后过滤,所得沉淀用蒸馏水洗涤2~3次;取最后一次洗涤后的滤液,滴加盐酸酸化的BaCl2溶液,不出现白色沉淀。
;则设计的实验方案为:在搅拌下向FeSO4溶液中缓慢加入氨水—NH4HCO3混合溶液,控制溶液pH不大于6.5;静置后过滤,所得沉淀用蒸馏水洗涤2~3次;取最后一次洗涤后的滤液,滴加盐酸酸化的BaCl2溶液,不出现白色沉淀,故答案为:在搅拌下向FeSO4溶液中缓慢加入氨水—NH4HCO3混合溶液,控制溶液pH不大于6.5;静置后过滤,所得沉淀用蒸馏水洗涤2~3次;取最后一次洗涤后的滤液,滴加盐酸酸化的BaCl2溶液,不出现白色沉淀。
【点睛】本题的易错点是实验方案设计中的细节,需注意两点:(1)控制pH不形成Fe(OH)2沉淀;(2)沉淀洗涤完全的标志。
以铁、硫酸、柠檬酸、双氧水、氨水等为原料可制备柠檬酸铁铵【(NH4)3Fe(C6H5O7)2】。
(1)Fe基态核外电子排布式为___________;![]() 中与Fe2+配位的原子是________(填元素符号)。
中与Fe2+配位的原子是________(填元素符号)。
(2)NH3分子中氮原子的轨道杂化类型是____________;C、N、O元素的第一电离能由大到小的顺序为_______________。
(3)与NH![]() 互为等电子体的一种分子为_______________(填化学式)。
互为等电子体的一种分子为_______________(填化学式)。
(4)柠檬酸的结构简式见图。1 mol柠檬酸分子中碳原子与氧原子形成的σ键的数目为_________mol。
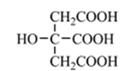
(1). 1s22s22p63s23p63d64s2或[Ar]3d64s2 (2). O (3). sp3 (4). N>O>C (5). CH4或SiH4 (6). 7
【解析】
【分析】
(1)Fe核外有26个电子,H2O中O原子有孤对电子,提供孤对电子。
(2)先计算NH3分子中氮原子价层电子对数,同周期,从左到右,第一电离能呈增大的趋势,但第IIA族大于第IIIA族,第VA族大于第VIA族。
(3)根据价电子数Si=C=N+的关系得出![]() 互为等电子体的分子。
互为等电子体的分子。
(4)羧基的结构是![]() ,一个羧基中有碳原子与氧原子分别形成两个σ键,一个羟基与碳原子相连形成一个σ键。
,一个羧基中有碳原子与氧原子分别形成两个σ键,一个羟基与碳原子相连形成一个σ键。
【详解】(1)Fe核外有26个电子,其基态核外电子排布式为1s22s22p63s23p63d64s2或[Ar]3d64s2;由于H2O中O原子有孤对电子,因此[Fe(H2O)6]2+中与Fe2+配位的原子是O;故答案为:1s22s22p63s23p63d64s2或[Ar]3d64s2;O。
(2)NH3分子中氮原子价层电子对数为![]() ,因此氮杂化类型为sp3,同周期,从左到右,第一电离能呈增大的趋势,但第IIA族大于第IIIA族,第VA族大于第VIA族,因此C、N、O元素的第一电离能由大到小的顺序为N>O>C;故答案为:sp3;N>O>C。
,因此氮杂化类型为sp3,同周期,从左到右,第一电离能呈增大的趋势,但第IIA族大于第IIIA族,第VA族大于第VIA族,因此C、N、O元素的第一电离能由大到小的顺序为N>O>C;故答案为:sp3;N>O>C。
(3)根据价电子数Si=C=N+,得出![]() 互为等电子体的分子是CH4或SiH4;故答案为:CH4或SiH4。
互为等电子体的分子是CH4或SiH4;故答案为:CH4或SiH4。
(4)羧基的结构是![]() ,一个羧基中有碳原子与氧原子分别形成两个σ键,三个羧基有6个,还有一个羟基与碳原子相连形成一个σ键,因此1mol柠檬酸分子中碳原子与氧原子形成的σ键的数目为7mol;故答案为:7。
,一个羧基中有碳原子与氧原子分别形成两个σ键,三个羧基有6个,还有一个羟基与碳原子相连形成一个σ键,因此1mol柠檬酸分子中碳原子与氧原子形成的σ键的数目为7mol;故答案为:7。
【点睛】物质结构是常考题型,主要考查电子排布式,电离能、电负性、共价键分类、杂化类型、空间构型等。
CO2/ HCOOH循环在氢能的贮存/释放、燃料电池等方面具有重要应用。
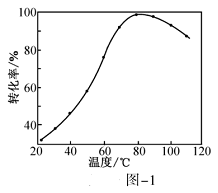
(1)CO2催化加氢。在密闭容器中,向含有催化剂的KHCO3溶液(CO2与KOH溶液反应制得)中通入H2生成HCOO-,其离子方程式为__________;其他条件不变,HCO3-转化为HCOO-的转化率随温度的变化如图-1所示。反应温度在40℃~80℃范围内,HCO3-催化加氢的转化率迅速上升,其主要原因是_____________。
(2) HCOOH燃料电池。研究 HCOOH燃料电池性能的装置如图-2所示,两电极区间用允许K+、H+通过的半透膜隔开。
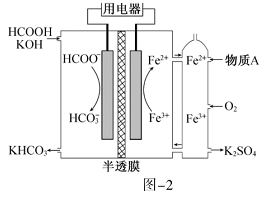
①电池负极电极反应式为_____________;放电过程中需补充的物质A为_________(填化学式)。
②图-2所示的 HCOOH燃料电池放电的本质是通过 HCOOH与O2的反应,将化学能转化为电能,其反应的离子方程式为_______________。
(3) HCOOH催化释氢。在催化剂作用下, HCOOH分解生成CO2和H2可能的反应机理如图-3所示。
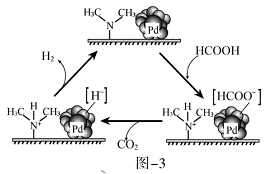
①HCOOD催化释氢反应除生成CO2外,还生成__________(填化学式)。
②研究发现:其他条件不变时,以 HCOOK溶液代替 HCOOH催化释氢的效果更佳,其具体优点是_______________。
(1). ![]() (2). 温度升高反应速率增大,温度升高催化剂的活性增强 (3).
(2). 温度升高反应速率增大,温度升高催化剂的活性增强 (3). ![]() (4). H2SO4 (5).
(4). H2SO4 (5). ![]() 或
或![]() (6). HD (7). 提高释放氢气的速率,提高释放出氢气的纯度
(6). HD (7). 提高释放氢气的速率,提高释放出氢气的纯度
【解析】
【分析】
(1)根据元素守恒和电荷守恒书写离子方程式;从温度对反应速率的影响以及温度对催化剂的影响的角度分析。
(2)该装置为原电池装置,放电时HCOOˉ转化为![]() 被氧化,所以左侧为负极,Fe3+转化为Fe2+被还原,所以右侧为正极。
被氧化,所以左侧为负极,Fe3+转化为Fe2+被还原,所以右侧为正极。
(3)HCOOH生成HCOOˉ和H+分别与催化剂结合,在催化剂表面HCOOˉ分解生成CO2和Hˉ,之后在催化剂表面Hˉ和第一步产生的H+反应生成H2。
【详解】(1)含有催化剂的KHCO3溶液中通入H2生成HCOOˉ,根据元素守恒和电荷守恒可得离子方程式为:![]() +H2
+H2![]() HCOOˉ+H2O;反应温度在40℃~80℃范围内时,随温度升高,活化分子增多,反应速率加快,同时温度升高催化剂的活性增强,所以
HCOOˉ+H2O;反应温度在40℃~80℃范围内时,随温度升高,活化分子增多,反应速率加快,同时温度升高催化剂的活性增强,所以![]() 的催化加氢速率迅速上升;
的催化加氢速率迅速上升;
(2)①左侧为负极,碱性环境中HCOOˉ失电子被氧化为![]() ,根据电荷守恒和元素守恒可得电极反应式为HCOOˉ+2OHˉ-2eˉ===
,根据电荷守恒和元素守恒可得电极反应式为HCOOˉ+2OHˉ-2eˉ=== ![]() +H2O;电池放电过程中,钾离子移向正极,即右侧,根据图示可知右侧的阴离子为硫酸根,而随着硫酸钾不断被排除,硫酸根逐渐减少,铁离子和亚铁离子进行循环,所以需要补充硫酸根,为增强氧气的氧化性,溶液最好显酸性,则物质A为H2SO4;
+H2O;电池放电过程中,钾离子移向正极,即右侧,根据图示可知右侧的阴离子为硫酸根,而随着硫酸钾不断被排除,硫酸根逐渐减少,铁离子和亚铁离子进行循环,所以需要补充硫酸根,为增强氧气的氧化性,溶液最好显酸性,则物质A为H2SO4;
②根据装置图可知电池放电的本质是HCOOH在碱性环境中被氧气氧化为![]() ,根据电子守恒和电荷守恒可得离子方程式为2HCOOH+O2+2OHˉ = 2
,根据电子守恒和电荷守恒可得离子方程式为2HCOOH+O2+2OHˉ = 2![]() +2H2O或2HCOOˉ+O2= 2
+2H2O或2HCOOˉ+O2= 2![]() ;
;
(3)①根据分析可知HCOOD可以产生HCOOˉ和D+,所以最终产物为CO2和HD(Hˉ与D+结合生成);
②HCOOK是强电解质,更容易产生HCOOˉ和K+,更快的产生KH,KH可以与水反应生成H2和KOH,生成的KOH可以吸收分解产生的CO2,从而使氢气更纯净,所以具体优点是:提高释放氢气的速率,提高释放出氢气的纯度。
【点睛】第3小题为本题难点,要注意理解图示的HCOOH催化分解的反应机理,首先HCOOH分解生成H+和HCOOˉ,然后HCOOˉ再分解成CO2和Hˉ,Hˉ和H+反应生成氢气。
次氯酸钠溶液和二氯异氰尿酸钠(C3N3O3Cl2Na)都是常用的杀菌消毒剂。 NaClO可用于制备二氯异氰尿酸钠.
(1)NaClO溶液可由低温下将Cl2缓慢通入NaOH溶液中而制得。制备 NaClO的离子方程式为__________;用于环境杀菌消毒的NaClO溶液须稀释并及时使用,若在空气中暴露时间过长且见光,将会导致消毒作用减弱,其原因是__________________。
(2)二氯异氰尿酸钠优质品要求有效氯大于60%。通过下列实验检测二氯异氰尿酸钠样品是否达到优质品标准。实验检测原理为![]()
![]()
![]()
准确称取1.1200g样品,用容量瓶配成250.0mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min;用![]() Na2S2O3标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗Na2S2O3溶液20.00mL。
Na2S2O3标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗Na2S2O3溶液20.00mL。
①通过计算判断该样品是否为优质品_______。(写出计算过程,![]() )
)
②若在检测中加入稀硫酸的量过少,将导致样品的有效氯测定值____________(填“偏高”或“偏低”)。
(1). ![]() (2). NaClO溶液吸收空气中的CO2后产生HClO,HClO见光分解 (3).
(2). NaClO溶液吸收空气中的CO2后产生HClO,HClO见光分解 (3). ![]()
根据物质转换和电子得失守恒关系:![]()
得![]()
氯元素的质量:
![]()
该样品的有效氯为: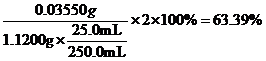
该样品的有效氯大于60%,故该样品为优质品 (4). 偏低
【解析】
【详解】(1) 由题意可知,氯气通入氢氧化钠中产生次氯酸钠,同时产生氯化钠,反应的离子方程式为:![]() ;次氯酸钠溶液长期暴露在空气中会吸收空气中的二氧化碳气体,因次氯酸酸性比碳酸弱,因此次氯酸钠可以与二氧化碳在水中反应产生HClO,HClO具有不稳定性,在受热或见光条件下会发生分解反应,产生HCl和O2,从而是次氯酸钠失效,故答案为:
;次氯酸钠溶液长期暴露在空气中会吸收空气中的二氧化碳气体,因次氯酸酸性比碳酸弱,因此次氯酸钠可以与二氧化碳在水中反应产生HClO,HClO具有不稳定性,在受热或见光条件下会发生分解反应,产生HCl和O2,从而是次氯酸钠失效,故答案为:![]() ;NaClO溶液吸收空气中的CO2后产生HClO,HClO见光分解;
;NaClO溶液吸收空气中的CO2后产生HClO,HClO见光分解;
(2) ①由题中反应可知,![]() 在酸性条件产生HClO,HClO氧化碘离子产生碘单质,碘单质再用硫代硫酸钠滴定,结合反应转化确定物质之间的关系为:
在酸性条件产生HClO,HClO氧化碘离子产生碘单质,碘单质再用硫代硫酸钠滴定,结合反应转化确定物质之间的关系为:![]() ,
, ![]() ,根据物质转换和电子得失守恒关系:得n(Cl)=0.5
,根据物质转换和电子得失守恒关系:得n(Cl)=0.5![]() =
=![]() ,
,
氯元素的质量:m(Cl)= ![]() =0.03550g,该样品中的有效氯为:
=0.03550g,该样品中的有效氯为: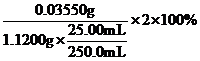 =63.39%,
=63.39%,
该样品中的有效氯大于60%,故该样品为优质品
故答案为:n(S2O![]() )=
)=![]() ,根据物质转换和电子得失守恒关系:
,根据物质转换和电子得失守恒关系:![]() ,得n(Cl)=0.5
,得n(Cl)=0.5![]() =
=![]() ,
,
氯元素的质量:m(Cl)= ![]() =0.03550g,该样品中的有效氯为:
=0.03550g,该样品中的有效氯为: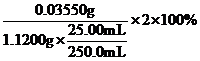 =63.39%,
=63.39%,
该样品中的有效氯大于60%,故该样品为优质品
②如果硫酸的用量过少,则导致反应![]() 不能充分进行,产生的HClO的量偏低,最终导致实验测得的有效氯含量会偏低,
不能充分进行,产生的HClO的量偏低,最终导致实验测得的有效氯含量会偏低,
故答案为:偏低;
本卷还有17题,登录并加入会员即可免费使用哦~

该作品由: 用户宋春妍分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。