CO2/ HCOOH循环在氢能的贮存/释放、燃料电池等方面具有重要应用。
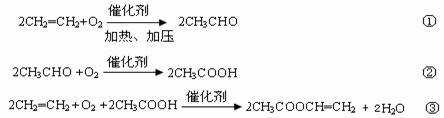
(1)CO2催化加氢。在密闭容器中,向含有催化剂的KHCO3溶液(CO2与KOH溶液反应制得)中通入H2生成HCOO-,其离子方程式为__________;其他条件不变,HCO3-转化为HCOO-的转化率随温度的变化如图-1所示。反应温度在40℃~80℃范围内,HCO3-催化加氢的转化率迅速上升,其主要原因是_____________。
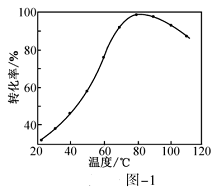
(2) HCOOH燃料电池。研究 HCOOH燃料电池性能的装置如图-2所示,两电极区间用允许K+、H+通过的半透膜隔开。
①电池负极电极反应式为_____________;放电过程中需补充的物质A为_________(填化学式)。
②图-2所示的 HCOOH燃料电池放电的本质是通过 HCOOH与O2的反应,将化学能转化为电能,其反应的离子方程式为_______________。
(3) HCOOH催化释氢。在催化剂作用下, HCOOH分解生成CO2和H2可能的反应机理如图-3所示。
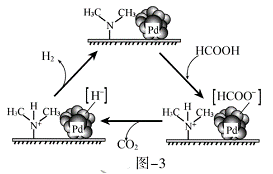
①HCOOD催化释氢反应除生成CO2外,还生成__________(填化学式)。
②研究发现:其他条件不变时,以 HCOOK溶液代替 HCOOH催化释氢的效果更佳,其具体优点是_______________。
答案
(1). ![]() (2). 温度升高反应速率增大,温度升高催化剂的活性增强 (3).
(2). 温度升高反应速率增大,温度升高催化剂的活性增强 (3). ![]() (4). H2SO4 (5).
(4). H2SO4 (5). ![]() 或
或![]() (6). HD (7). 提高释放氢气的速率,提高释放出氢气的纯度
(6). HD (7). 提高释放氢气的速率,提高释放出氢气的纯度
【解析】
【分析】
(1)根据元素守恒和电荷守恒书写离子方程式;从温度对反应速率的影响以及温度对催化剂的影响的角度分析。
(2)该装置为原电池装置,放电时HCOOˉ转化为![]() 被氧化,所以左侧为负极,Fe3+转化为Fe2+被还原,所以右侧为正极。
被氧化,所以左侧为负极,Fe3+转化为Fe2+被还原,所以右侧为正极。
(3)HCOOH生成HCOOˉ和H+分别与催化剂结合,在催化剂表面HCOOˉ分解生成CO2和Hˉ,之后在催化剂表面Hˉ和第一步产生的H+反应生成H2。
【详解】(1)含有催化剂的KHCO3溶液中通入H2生成HCOOˉ,根据元素守恒和电荷守恒可得离子方程式为:![]() +H2
+H2![]() HCOOˉ+H2O;反应温度在40℃~80℃范围内时,随温度升高,活化分子增多,反应速率加快,同时温度升高催化剂的活性增强,所以
HCOOˉ+H2O;反应温度在40℃~80℃范围内时,随温度升高,活化分子增多,反应速率加快,同时温度升高催化剂的活性增强,所以![]() 的催化加氢速率迅速上升;
的催化加氢速率迅速上升;
(2)①左侧为负极,碱性环境中HCOOˉ失电子被氧化为![]() ,根据电荷守恒和元素守恒可得电极反应式为HCOOˉ+2OHˉ-2eˉ===
,根据电荷守恒和元素守恒可得电极反应式为HCOOˉ+2OHˉ-2eˉ=== ![]() +H2O;电池放电过程中,钾离子移向正极,即右侧,根据图示可知右侧的阴离子为硫酸根,而随着硫酸钾不断被排除,硫酸根逐渐减少,铁离子和亚铁离子进行循环,所以需要补充硫酸根,为增强氧气的氧化性,溶液最好显酸性,则物质A为H2SO4;
+H2O;电池放电过程中,钾离子移向正极,即右侧,根据图示可知右侧的阴离子为硫酸根,而随着硫酸钾不断被排除,硫酸根逐渐减少,铁离子和亚铁离子进行循环,所以需要补充硫酸根,为增强氧气的氧化性,溶液最好显酸性,则物质A为H2SO4;
②根据装置图可知电池放电的本质是HCOOH在碱性环境中被氧气氧化为![]() ,根据电子守恒和电荷守恒可得离子方程式为2HCOOH+O2+2OHˉ = 2
,根据电子守恒和电荷守恒可得离子方程式为2HCOOH+O2+2OHˉ = 2![]() +2H2O或2HCOOˉ+O2= 2
+2H2O或2HCOOˉ+O2= 2![]() ;
;
(3)①根据分析可知HCOOD可以产生HCOOˉ和D+,所以最终产物为CO2和HD(Hˉ与D+结合生成);
②HCOOK是强电解质,更容易产生HCOOˉ和K+,更快的产生KH,KH可以与水反应生成H2和KOH,生成的KOH可以吸收分解产生的CO2,从而使氢气更纯净,所以具体优点是:提高释放氢气的速率,提高释放出氢气的纯度。
【点睛】第3小题为本题难点,要注意理解图示的HCOOH催化分解的反应机理,首先HCOOH分解生成H+和HCOOˉ,然后HCOOˉ再分解成CO2和Hˉ,Hˉ和H+反应生成氢气。