甲、乙、丙三个体积为 VL 的容器,在甲、乙、丙中分别加入不同量的 A 和 B ,发生反应 A(g)+2B(g) ⇌ C(s) +Q(Q>0) , T 1 ℃ 时,该反应的 K=0.25 ,下表是 T 1 °C 时, t 1 时刻的 A 和 B 的浓度,下列说法正确的是
| | A | B |
| 甲 | 4mol/L | 1mol/L |
| 乙 | 3mol/L | 6mol/L |
| 丙 | 1mol/L | 2mol/L |
A .此时,甲中 V 正 >V 逆
B .平衡时,乙和丙容器内气体的密度不相等
C .平衡时,降低温度,可使乙中 c(A)=3mo1/L
D .连通甲和丙,达到平衡后, c(A)<2.5mo1/L
D
【解析】
【详解】
A .此时,甲中 ,反应达到平衡状态, V 正 =V 逆 ,故 A 错误;
B .投料比等于系数比,则 A 、 B 平衡浓度比也等于系数比,设平衡时,乙中 A 的浓度为 x mol/L 、 B 的平衡浓度为 2x mol/L ;丙溶液中 A 平衡的浓度为 y mol/L 、 B 的平衡浓度为 2y mol/L ;平衡常数相等, ,所以 x=y ,乙和丙容器内气体的密度相等,故 B 错误;
C .若平衡时乙中 c(A)=3mo1/L ,则 c(B)=6mo1/L , ,正反应放热,降低温度,平衡正向移动,平衡常数大于 0.25 ,故 C 错误 ;
D .连通甲和丙,则 A 的起始浓度为 2.5mo1/L 、 B 的起始浓度为 1.5mo1/L , ,平衡正向移动,达到平衡后, c(A)<2.5mo1/L ,故 D 正确;
选 D 。
25℃ 下,向 20mL0.1mol/LH 2 A 溶液中滴加 0.1mol/LNaOH 溶液,有关粒子物质的量的变化如图所示。下列有关说法正确的是
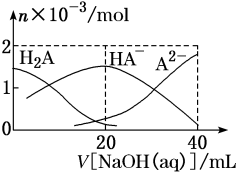
A . H 2 A 属于强酸
B . c(HA - )/c(H 2 A) 随着 V NaOH 的增大而减小
C . V NaOH =20mL 时,溶液中存在关系: c(HA - )+c(A 2- )+c(H 2 A)=0.lmol/L
D . V NaOH =20mL 时,溶液中存在关系: c(Na + )>c(HA - )>c(H + )>c(A 2- )>c(OH - )
D
【解析】
【详解】
A . 20mL0.1mol/LH 2 A 溶液中含有 H 2 A 分子,所以 H 2 A 是弱酸,故 A 错误;
B . ,随着 V( NaOH ) 的增大, c(H + ) 减小,所以
增大,故 B 错误;
C .根据物料守恒, V( NaOH )= 20mL 时,溶液中存在关系: c(HA - )+c(A 2- )+c(H 2 A)=0.05mol/L ,故 C 错误;
D . V( NaOH )= 20mL 时,溶质为 NaHA ,根据图像可知 c(A 2- )>c(H 2 A) , HA - 的电离大于水解,溶液呈酸性,所以 c(Na + )>c(HA - )>c(H + )>c(A 2- )>c(OH - ) ,故 D 正确;
选 D 。
部分弱酸的酸性如下: HCOOH>H 2 CO 3 >HCN> 下列选项错误的是
A . CN - +H 2 O+CO 2 →HCN+
B . 2HCOOH+ →2HCOO - +H 2 O+CO 2 ↑
C .中和等体积、等 pH 的 HCOOH 和 HCN 消耗 NaOH 的量前者小于后者
D .等体积、等浓度的 HCOONa 和 NaCN 溶液中所含离子总数前者小于后者
D
【解析】
【详解】
A .根据表中数据判断酸性 HCN> ,所以二氧化碳与 CN - 的反应为 CN - +H 2 O+CO 2 →HCN+
,正确;
B . HCOOH > H 2 CO 3 ,所以 HCOOH 可以与 反应制取二氧化碳,正确;
C .等体积、等 pH 的 HCOOH 和 HCN 溶液中,后者的浓度大于前者,所以消耗 NaOH 的量前者小于后者,正确;
D .根据电荷守恒, c(HCOO - )+c(OH - )=c(Na + )+c(H + ) , c(CN - )+c(OH - )=c(Na + )+c(H + ) ,即离子总数是 n(Na + )+n(H + ) 的 2 倍,而 NaCN 的水解程度大,即 NaCN 溶液中的 c(OH - ) 大, c(H + ) 小, c(Na + ) 相同,所以甲酸钠中离子浓度大,错误;
答案选 D 。
下列关于工业生产过程的叙述正确的是
A .联合制碱法中循环使用 CO 2 和 NH 3 ,以提高原料利用率
B .硫酸工业中, SO 2 氧化为 SO 3 时采用常压,因为高压会降低 SO 2 转化率
C .合成氨生产中将 NH 3 液化分离,可加快正反应速率,提高 N 2 、 H 2 的转化率
D . SO 2 在接触室被氧化成 SO 3 , SO 3 在吸收塔内被吸收制成浓硫酸
D
【解析】
【详解】
A .联合制碱法中,碳酸氢钠受热分解生成碳酸钠和二氧化碳,二氧化碳被循环利用,而氯化铵并没有直接循环利用,而是作为其他化工原料,则氨气没有被循环利用,故 A 错误;
B .对于该反应,常压时转化率就很高了,增大压强对 SO 2 的转化率影响不大,同时会增大成本,故通常采用常压而不是高压,故 B 错误;
C .合成氨生产过程中将 NH 3 液化分离,导致生成物浓度减小,逆反应速率瞬间减小,正反应速率随之减小,平衡向正反应方向移动,从而提高了 N 2 、 H 2 的转化率,故 C 错误;
D . SO 2 在接触室被氧化成 SO 3 , SO 3 在吸收塔内被吸收制成浓硫酸,故 D 正确;
答案选 D 。
氯气用途广泛,但在使用时,一般会产生氯化氢,工业上可用 O 2 将 HCl 转化为 Cl 2 ,以提高效益,减少污染,反应为: O 2 (g)+4HCl(g) ⇌ 2Cl 2 (g)+2H 2 O(g)+QkJ(Q>0) 。对该反应达到平衡后,以下分析正确的是
A .增加 n(HCl) ,逆反应速率先减小后增大
B .体积不变加入稀有气体,对正反应的反应速率影响更大
C .压强不变加入稀有气体,对正反应的反应速率影响更大
D .如果平衡常数 K 值增大,对正反应的速率影响更大
C
【解析】
【详解】
A .增加 n(HCl) ,平衡正向移动,逆反应速率增大, A 错误;
B .体积不变加入稀有气体,参与反应各物质的浓度不变,平衡不移动,正逆反应速率不变, B 错误;
C .压强不变加入稀有气体,则体积变大,相当于对原平衡体系减压,则平衡逆向移动,所以正反应的反应速率下降的更多,对正反应的反应速率影响更大, C 正确;
D .如果平衡常数 K 值增大,即平衡正向移动,即正反应速率大于逆反应速率,由于该反应为放热反应,所以要降低温度,所以逆反应速率下降的要比正反应速率多,对逆反应速率的影响更大, D 错误;
答案选 C 。
本卷还有35题,登录并加入会员即可免费使用哦~

该作品由: 用户罗晓分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。