室温下,用 0.20mol·L -1 NaOH 溶液滴定 20.0mL 一元酸 HR 溶液时,溶液的 pH 变化情况如图所示,其中, a 点表示两种物质刚好中和 ( 忽略溶液体积变化 ) 。下列有关说法正确的是
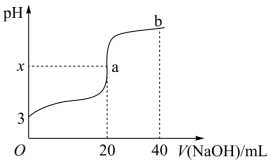
A . HR 一定为一元强酸, x=7
B . HR 的电离平衡常数 K a=5.0×10 -3
C . a 点溶液中: c (R — )+ c (OH — )— c (H + )=0.1mol/L
D . b 点溶液中: c (Na + )> c (R — )> c (OH — )>c(H + )
C
【解析】
【分析】
由 a 点表示两种物质刚好中和可知,一元酸 HR 溶液的浓度为 0.2mol/L ,由图可知, 0.2mol/LHR 溶液的 pH 为 3 ,说明 HR 在溶液中部分电离,属于一元弱酸,则 a 点为 NaR 溶液, NaR 在溶液中水解,使溶液呈碱性, b 点为等浓度的 NaR 和 NaOH 混合溶液。
【详解】
A .由分析可知, a 点为 NaR 溶液, NaR 在溶液中水解,使溶液呈碱性,溶液 pH 大于 7 ,则 x>7 ,故 A 错误;
B .由分析可知, HR 为一元弱酸, 0.2mol/LHR 溶液的 pH 为 3 ,则电离平衡常数 K a= ≈
=5.0×10 -6 ,故 B 错误;
C .由分析可知, a 点为 NaR 溶液,溶液中存在电荷守恒关系 c (R — )+ c (OH — )= c (H + )+ c (Na + ) ,则 c (R — )+ c (OH — )— c (H + )= c (Na + )= =0.1mol/L ,故 C 正确;
D .由分析可知, b 点为等浓度的 NaR 和 NaOH 混合溶液,溶液中离子浓度的大小顺序为 c (Na + )> c (OH — )> c (R — )> c(H + ) ,故 D 错误;
故选 C 。
在实验室采用如图装置制备气体,方法合理的是
| | 化学试剂 | 制备气体 | |
| A | Ca(OH) 2 +NH 4 Cl | NH 3 | |
| B | MnO 2 +HCl( 浓 ) | Cl 2 | |
| C | MnO 2 +KClO 3 | O 2 | |
| D | HCl+CaCO 3 | CO 2 |
A . A B . B C . C D . D
C
【解析】
【详解】
由实验装置图可知,制备气体的装置为固固加热装置,收集气体的装置为向上排空气法,说明该气体的密度大于空气的密度;
A .氨气的密度比空气小,不能用向上排空法收集,故 A 错误;
B .二氧化锰与浓盐酸共热制备氯气为固液加热反应,需要选用固液加热装置,不能选用固固加热装置,故 B 错误;
C .二氧化锰和氯酸钾共热制备氧气为固固加热的反应,能选用固固加热装置,氧气的密度大于空气,可选用向上排空气法收集,故 C 正确;
D .盐酸与碳酸钙制备二氧化碳为固液反应,需要选用固液不加热装置,不能选用固固加热装置,故 D 错误;
故答案为 C 。
已知 (HF) 2 (g) ⇌ 2HF(g) ΔH>0 ,平衡体系的气体总质量 (m 总 ) 与总物质的量 (n 总 ) 之比在不同温度下随压强的变化曲线如图所示。下列说法正确的是

A .温度: T 1 <T 2
B .平衡常数: K(a)=K(b)<K(c)
C .反应速率: v a 正 >v b 正
D .当 =30g·mol -1 时, n(HF)∶n[(HF) 2 ]=1∶1
D
【解析】
【详解】
A .由图像可知, b 、 c 两个点的压强相同, T 2 温度下 c 点对应的平均摩尔质量大于 T 1 温度下 b 点对应的平均摩尔质量,反应前后气体总质量保持不变,平均摩尔质量大说明气体总物质的量小,即 T 2 温度时,平衡向逆反应方向移动,该反应的正反应为吸热反应,降低温度,平衡向逆反应方向移动, T 2 < T 1 ,故 A 错误;
B .由于温度 T2 < T1 ,该反应的正反应为吸热反应,温度越高,平衡常数 K 越大,所以平衡常数 K(a)=K(c) < K(b) ,故 B 错误;
C . b 点对应的温度 T 1 和压强大于 a 点对应的温度 T 2 和压强,温度越高、压强越大,反应速率越快,所以反应速率 v a 正 <v b 正 ,故 C 错误;
D .当 =30g•mol -1 时,设 HF 物质的量为 xmol , (HF) 2 的物质的量为 ymol ,
=30g•mol -1 ,解得 x : y=1 : 1 , n(HF) : n[(HF) 2 ]=1 : 1 ,故 D 正确;
故选: D 。
用如图装置制取、提纯并收集表中的四种气体 (a 、 b 、 c 表示相应仪器中加入的试剂,必要时可以加热 ) ,其中可行的是
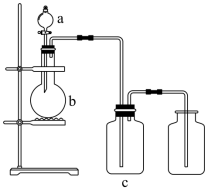
| 选项 | 气体 | a | b | c |
| A | SO 2 | 浓硫酸 | 铜 | 饱和 Na 2 SO 3 溶液 |
| B | NO 2 | 浓硝酸 | 铜片 | NaOH 溶液 |
| C | Cl 2 | 浓盐酸 | 二氧化锰 | 饱和碳酸氢钠溶液 |
| D | CO 2 | 稀硫酸 | Na 2 CO 3 | 浓硫酸 |
A . A B . B C . C D . D
D
【解析】
【详解】
A .饱和 Na 2 SO 3 溶液能与 SO 2 反应,生成 NaHSO 3 ,从而吸收 SO 2 , A 不可行;
B . NaOH 溶液能吸收 NO 2 ,生成 NaNO 3 、 NaNO 2 等, B 不可行;
C .饱和碳酸氢钠溶液能与氯水中的盐酸反应,从而增大氯气在溶液中的溶解度, C 不可行;
D .稀硫酸与碳酸钠反应可生成 CO 2 气体,浓硫酸能干燥 CO 2 , D 可行;
故选 D 。
对于可逆反应 2AB 3 (g) 2A(g)+3B 2 (g)ΔH>0 ,下列图像不正确的是
A . 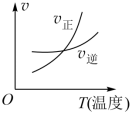 B .
B . 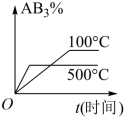
C .  D .
D . 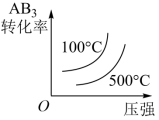
C
【解析】
【详解】
A .对于可逆反应 2AB 3 (g) 2A(g)+3B 2 (g)ΔH>0 ,升高温度,平衡正向移动,温度对正反应速率的影响大于逆反应速率,故 A 正确;
B .对于可逆反应 2AB 3 (g) 2A(g)+3B 2 (g) ,升高温度,平衡正向移动, AB 3 的百分含量减小,故 B 正确;
C . 2AB 3 (g) 2A(g)+3B 2 (g) 正反应气体物质的量增大,增大压强平衡逆向移动, AB 3 的百分含量增大,故 C 错误;
D .对于可逆反应 2AB 3 (g) 2A(g)+3B 2 (g)ΔH>0 ,升高温度,平衡正向移动, AB 3 的百分含量减小; 2AB 3 (g)
2A(g)+3B 2 (g) 正反应气体物质的量增大,增大压强平衡逆向移动, AB 3 的百分含量增大,故 D 正确;
选 C 。
本卷还有39题,登录并加入会员即可免费使用哦~

该作品由: 用户凤凰座战士分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。