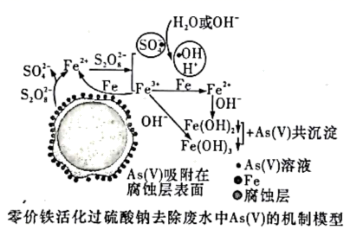
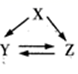在给定条件下,下列选项所示物质间不满足每一步转化均能实现的是
A . Na 2 O 2 Na 2 SO 3
FeSO 4
B . Cu 2 S SO 2
H 2 SO 4
C . Al NaAlO 2
Al(OH) 3
D . Fe(s) Fe 3 O 4 (s)
Fe(NO 3 ) 3 (aq)
答案
A
【详解】 A .虽然 Na 2 SO 3 与 Fe 2 (SO 4 ) 3 能发生氧化还原反应生成 FeSO 4 ,但 Na 2 O 2 与 SO 2 反应,生成 Na 2 SO 4 , A 符合题意;
B . Cu 2 S 在高温下被 O 2 氧化生成 Cu 和 SO 2 , SO 2 被 H 2 O 2 氧化生成 H 2 SO 4 , B 不符合题意;
C . Al 与 NaOH 溶液反应生成 NaAlO 2 和 H 2 , NaAlO 2 溶液中通入足量 CO 2 ,生成 Al(OH) 3 和 NaHCO 3 , C 不符合题意;
D . Fe(s) 与高温水蒸气反应,可生成 Fe 3 O 4 (s) 和 H 2 , Fe 3 O 4 被硝酸氧化,生成 Fe(NO 3 ) 3 (aq) 等, D 不符合题意;
故选 A 。