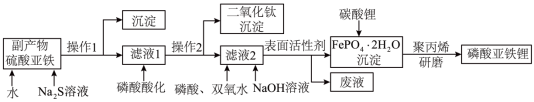
磷酸亚铁锂 (LiFePO 4 ) 是重要的俚电池正极材料,一种利用硫酸法生产钛白粉过程的副产物硫酸亚铁 ( 含钛、铜、锰、铅、锌、钙、镁等杂质离子 ) 制备磷酸亚铁锂的生产流程如图。
常温下各种硫化物溶度积常数如表:
| 物质 | FeS | MnS | CuS | PbS | ZnS |
| K sp | 6.3×10 -18 | 2.5×10 -13 | 1.3×10 -36 | 3.4×10 -28 | 1.6×10 -24 |
回答下列问题:
(1) 操作 1 、操作 2 的实验操作名称为 ____ 。
(2) 加入 Na 2 S 溶液的目的是 ____ ,聚丙烯的作用是 ____ 。
(3) 向滤液 2 中加入 NaOH 溶液需控制溶液的 pH≤2.2 ,其原因为 ____ ;反应生成 FePO 4 •2H 2 O 的离子方程式为 ____ 。
(4) 已知: K sp (MgF 2 )=9×10 -9 、 K sp (CaF 2 )=1.5×10 -10 。若取 1.0L 废液,测得 Ca 2+ 浓度为 0.02mol/L , Mg 2+ 浓度为 0.01mol/L ,则至少需加入 ____gNaF 才能使废液中 Mg 2+ 沉淀完全 ( 当离子浓度 ≤1×10 -5 mol·L -1 ,可认为沉淀完全 ) 。
(5) 锂离子电池在充电时, LiFePO 4 作 ____( 填 “ 阳 ” 或 “ 阴 ”) 极,脱出部分 Li + ,进而形成 Li 1-x FePO 4 。
答案
(1) 过滤
(2) 除去溶液中的 Cu 2+ 、 Pb 2+ 、 Zn 2+ 将 Fe 3+ 还原成 Fe 2+
(3) pH 偏大时,会生成 Fe(OH) 3 ,使制备的 FePO 4 •2H 2 O 质量较差 2Fe 2+ +2H 3 PO 4 +2H 2 O+H 2 O 2 =2FePO 4 •2H 2 O↓+4H +
(4)3.78
(5) 阳
【分析】加入 Na 2 S 除去溶液中的 Cu 2+ 、 Pb 2+ 、 Zn 2+ ,沉淀为 CuS 、 PbS 、 ZnS ,加入磷酸酸化过滤出二氧化钛,亚铁离子与双氧水和 NaOH 溶液反应生成 FePO 4 ∙2H 2 O ,聚丙烯可将 Fe 3+ 还原成 Fe 2+ ,加入碳酸锂反应得到磷酸亚铁锂;
( 1 )
由生产流程图知操作 1 、操作 2 是分离固体和液体混合物的方法,是过滤;
( 2 )
加入 溶液的目的是除去杂质离子,但不影响溶液中
的含量,结合题给硫化物溶度积常数可知能够除去的杂质离子为
;由流程知加入碳酸锂和聚丙烯后生成磷酸亚铁锂,铁元素价态降低,故加入聚丙烯的作用是将
还原成
;
( 3 )
酸性条件下过氧化氢将 氧化成
,
易水解, pH 过大时主要生成氢氧化铁沉淀,产品质量较差。由流程图知,向滤液 2 中加入磷酸、双氧水与
发生氧化还原反应生成磷酸铁晶体,反应的离子方程式为
;
( 4 )
若取 废液,测得
浓度为
,
浓度为
,加入
生成 0
沉淀,消耗
,沉淀后溶液中的
,其物质的量为
,则至少需要加入
的质量为
,则
的质量为
;
( 5 )
锂离子电池充电时, 生成
,铁元素化合价升高作阳极。

 ” 水解是吸热过程,是中和反应的逆过程。一般,水解的程度较小,写离子方程式时,不能用“↑”或“↓”符号。多元弱酸根分步水解,以第一步为主。多元弱碱阳离子一步水解。
” 水解是吸热过程,是中和反应的逆过程。一般,水解的程度较小,写离子方程式时,不能用“↑”或“↓”符号。多元弱酸根分步水解,以第一步为主。多元弱碱阳离子一步水解。 

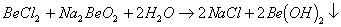 能完全进行,则下列推断中,正确的是
能完全进行,则下列推断中,正确的是 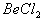 溶液的pH<7,将其蒸干并灼烧后,得到的残留物可能为BeO
溶液的pH<7,将其蒸干并灼烧后,得到的残留物可能为BeO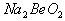 溶液的pH>7,将其蒸干并灼烧后,得到的残留物可能为BeO
溶液的pH>7,将其蒸干并灼烧后,得到的残留物可能为BeO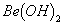 既能溶于盐酸又能溶于烧碱溶液
既能溶于盐酸又能溶于烧碱溶液