四氧化三铁 (Fe 3 O 4 ) 磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具。水热法制备 Fe 3 O 4 磁性纳米颗粒的反应是 3Fe 2+ +2 +O 2 +xOH - =Fe 3 O 4 +
+2H 2 O 。下列叙述不正确的是
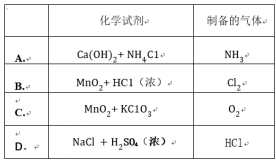
A .水热法制备 Fe 3 O 4 磁性纳米颗粒的反应中,还原剂是 、 Fe 2+
B .离子方程式中 x=4
C .每生成 1molFe 3 O 4 ,转移电子 2mol
D .该条件下 O 2 氧化性强于
答案
C
【解析】
【分析】
根据反应 3Fe 2+ +2 +O 2 +xOH - =Fe 3 O 4 +
+2H 2 O , O 元素化合价降低,由 0 降到 -2 , 1 个 O 2 得 4 个电子, O 2 作氧化剂; Fe 元素化合价升高,由 +2 升到 +3 ,由于 Fe 3 O 4 中 +3 价 Fe 占
,故 3 个 Fe 2+ 中有两个 Fe 2+ 失电子,失去电子的数目为
=2 个, Fe 2+ 作还原剂; S 元素化合价升高,由 +2 升到 +2.5 ,故 1 个
失电子的数目为
=2 个,
作还原剂。
【详解】
A .根据上述分析,还原剂是 Fe 2+ 、 , A 项正确;
B .方程式等号左右电荷要守恒,故 x=4 ,保证等号左右电荷代数和均为 -2 , B 项正确;
C .由反应方程式可知,生成 1mol Fe 3 O 4 需要消耗 1mol O 2 ,转移电子 4mol , C 项错误;
D .该条件下 O 2 作氧化剂, 为氧化产物,故 O 2 氧化性强于
, D 项正确;
答案选 C 。
【点睛】
计算复杂物质化合价时可以采用 “ 整体法 ” ,比如本题中 2 →
,可以把 4 份的 S 看成一个整体, 2
中 “S 4 ” 总化合价为 +8 ,
中 “S 4 ” 总化合价为 +10 ,即可马上得出失电子 =10-8=2 ;计算转移电子时,只需计算出得电子或失电子一种关系即可,例如本题中,还原剂的化合价计算不方便,氧化剂只有一种 O 2 ,因此只需算出 O 2 得 4 倍电子,即可得出转移电子也为 4 倍。