饱和甘汞电极 (Hg-Hg 2 Cl 2 ) 常被用作参比电极测定某电极的电极电位,其内部构造如图所示,在测定电池的电动势后,才可以标出被测电极的电极电位。当甘汞电极与锌电极共同插入 ZnCl 2 溶液中构成原电池时,下列说法 不正确 的是
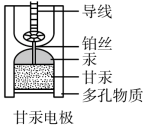
A .甘汞电极电势比较稳定,故可作为参比电极
B .多孔物质的作用是隔离甘汞与氯化锌溶液
C .负极的电极反应式为 Zn-2e - =Zn 2+
D .正极的电极反应式为 Hg 2 Cl 2 +2e - =2Hg+2Cl -
答案
B
【解析】
【详解】
A .甘汞电极的电势比较稳定,故可作为参比电极, A 正确;
B .多孔物质是与被测溶液接触的通道,因此不能隔离甘汞与氯化锌溶液, B 错误;
C .当甘汞电极与锌电极共同插入 ZnCl 2 溶液中构成原电池时, Zn 电极为负极,失去电子变为 Zn 2+ ,负极的电极反应式为 Zn-2e - =Zn 2+ , C 正确;
D .甘汞电极为原电池的正极,正极上 Hg 2 Cl 2 得到电子被还原产生 Hg ,产生产生 Cl - ,故正极的电极反应式为: Hg 2 Cl 2 +2e - =2Hg+2Cl - , D 正确;
故合理选项是 B 。



 B
B
 D
D