25℃ 下,向 20mL0.1mol/LH 2 A 溶液中滴加 0.1mol/LNaOH 溶液,有关粒子物质的量的变化如图所示。下列有关说法正确的是
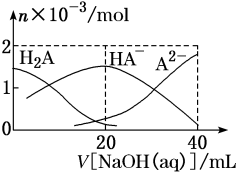
A . H 2 A 属于强酸
B . c(HA - )/c(H 2 A) 随着 V NaOH 的增大而减小
C . V NaOH =20mL 时,溶液中存在关系: c(HA - )+c(A 2- )+c(H 2 A)=0.lmol/L
D . V NaOH =20mL 时,溶液中存在关系: c(Na + )>c(HA - )>c(H + )>c(A 2- )>c(OH - )
答案
D
【解析】
【详解】
A . 20mL0.1mol/LH 2 A 溶液中含有 H 2 A 分子,所以 H 2 A 是弱酸,故 A 错误;
B . ,随着 V( NaOH ) 的增大, c(H + ) 减小,所以
增大,故 B 错误;
C .根据物料守恒, V( NaOH )= 20mL 时,溶液中存在关系: c(HA - )+c(A 2- )+c(H 2 A)=0.05mol/L ,故 C 错误;
D . V( NaOH )= 20mL 时,溶质为 NaHA ,根据图像可知 c(A 2- )>c(H 2 A) , HA - 的电离大于水解,溶液呈酸性,所以 c(Na + )>c(HA - )>c(H + )>c(A 2- )>c(OH - ) ,故 D 正确;
选 D 。

 ” 水解是吸热过程,是中和反应的逆过程。一般,水解的程度较小,写离子方程式时,不能用“↑”或“↓”符号。多元弱酸根分步水解,以第一步为主。多元弱碱阳离子一步水解。
” 水解是吸热过程,是中和反应的逆过程。一般,水解的程度较小,写离子方程式时,不能用“↑”或“↓”符号。多元弱酸根分步水解,以第一步为主。多元弱碱阳离子一步水解。 

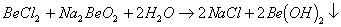 能完全进行,则下列推断中,正确的是
能完全进行,则下列推断中,正确的是 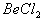 溶液的pH<7,将其蒸干并灼烧后,得到的残留物可能为BeO
溶液的pH<7,将其蒸干并灼烧后,得到的残留物可能为BeO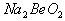 溶液的pH>7,将其蒸干并灼烧后,得到的残留物可能为BeO
溶液的pH>7,将其蒸干并灼烧后,得到的残留物可能为BeO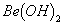 既能溶于盐酸又能溶于烧碱溶液
既能溶于盐酸又能溶于烧碱溶液