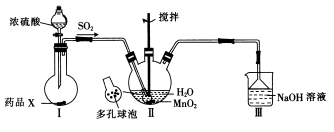
磺酰氯 (SO 2 Cl 2 ) 可用于制造锂电池正极活性物质。实验室可利用 SO 2 和 Cl 2 在活性炭催化下反应制取少量 SO 2 Cl 2 ,装置如图 ( 部分夹持装置已省略 ) 。

已知: ①SO 2 (g)+Cl 2 (g)=SO 2 Cl 2 (1) △H=-97.3kJ/mol 。
②SO 2 Cl 2 熔点为 -54.1°C ,沸点 69.1°C ,常温较稳定。遇水剧烈水解, 100°C 以上易分解。
回答下列问题:
(1) 仪器 A 的名称是 _______ ,装置丙中橡胶管的作用是 _______ 。
(2) 装置丙中发生反应的离子反应方程式为 _______ ,上述仪器正确的连接顺序是 e→_______→g , h←_______←f( 填仪器接口字母编号,仪器可重复使用 ) 。
(3) 仪器 F 的作用是 _______ 。
(4) 装置丁中三颈烧瓶置于冷水浴中,其原因是 _______ 。
(5) 使用 Li-SO 2 Cl 2 电池作为电源,采用四室式电渗析法制备 Ni(H 2 PO 2 ) 2 和 NaOH ,其工作原理如图所示。已知电池反应为 2Li+SO 2 Cl 2 =2LiCl+SO 2 ↑ 。下列说法正确的是 _______( 填标号 ) 。
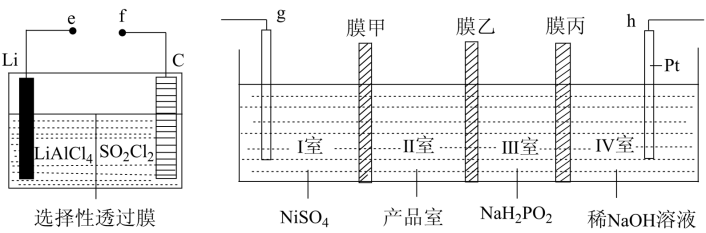
A .电池中 C 电极的电极反应式为 SO 2 Cl 2 +2e - =2Cl - +SO 2 ↑
B .膜甲、膜丙分别为阳离子交换膜、阴离子交换膜
C . g 为 Ni 电极,连接电池的正极
D .一段时间后, I 室和 IV 室中溶液的 pH 均升高
(6) 某实验小组利用该装置消耗了氯气 1120mL( 已转化为标准状况, SO 2 足量 ) ,最后得到纯净的磺酰氯 4.0g ,则磺酰氯的产率为 _______( 结果保留三位有效数字 ) 。
答案
(1) 蒸馏烧瓶 平衡气压,使液体顺利滴下
(2) 2 + 10Cl - +16H + =2Mn 2+ +5Cl 2 ↑+8H 2 O cdab ba
(3) 吸收 SO 2 、 Cl 2 ,防止污染空气;同时防止水蒸气进同意使磺酰氯水解
(4) 因为制备 SO 2 Cl 2 的反应为放热反应, SO 2 Cl 2 沸点低,温度过高易气化且易分解
(5)AC
(6)59.3%
【解析】
【分析】
丙装置制备氯气,戊装置制备二氧化硫,二氧化硫与氯气在丁中反应生成 SO 2 Cl 2 ,丁中活性炭可能起催化剂作用, SO 2 Cl 2 遇水发生剧烈的水解反应,甲为干燥二氧化硫,乙是饱和食盐水,降低氯气溶解度,甲干燥氯气, SO 2 Cl 2 沸点低、易挥发, B 为冷凝管,使挥发的产物 SO 2 Cl 2 冷凝回流,碱石灰吸收为反应的二氧化硫、氯气,防止污染空气,并吸收空气中的水蒸气,防止进入 C 中导致磺酰氯水解。
(1)
根据仪器的构造可知,仪器 A 的名称是蒸馏烧瓶,当分液漏斗上部压强大于烧瓶内压强时,分液漏斗内液体才能顺利流下,所以橡皮管起到平衡气压,使液体顺利流下的作用,装置丙中橡胶管的作用是平衡气压,使液体顺利滴下;
(2)
装置丙中高锰酸钾与浓盐酸反应生成氯化锰、氯化钾、氯气和水,发生反应的离子反应方程式为 2 + 10Cl - +16H + =2Mn 2+ +5Cl 2 ↑+8H 2 O ,实验装置的顺序是氯气制备装置 → 除杂装置 → 干燥装置 → 反应装置 ← 干燥装置 ← 二氧化硫制备装置,上述仪器正确的连接顺序是 e→c→d→a→b→g , h←b←a←f ;
(3)
仪器 F 装有碱石灰,其作用是吸收 SO 2 、 Cl 2 ,防止污染空气;同时防止水蒸气进同意使磺酰氯水解;
(4)
因为制备 SO 2 Cl 2 的反应为放热反应, SO 2 Cl 2 沸点低,温度过高易气化且易分解,故装置丁中三颈烧瓶置于冷水浴中;
(5)
结合题图,可知,原电池负极 : 原电池正极 :SO 2 Cl 2 +2e - =2Cl - +SO 2 ↑ 。电解池阴极 ( 不锈钢极 ) :2H 2 O+2e - =H 2 ↑+2OH - ,阳极 ( 镍 ) : Ni- 2e- = Ni 2+ 。
A .由已知电池反应可知 C 电极为正极,发生还原反应,电极反应式为 SO 2 Cl 2 +2e - =2Cl - +SO 2 ↑ ,选项 A 正确;
B . Ⅱ 室为产品室,故阳极上镍失去电子生成 Ni 2+ 通过膜甲进入产品室, Ⅲ 室中的 通过膜乙进入产品室,与 Ni 2+ 形成 Ni(H 2 PO 2 ) 2 ,故膜甲为阳离子交换膜,膜乙为阴离子交换膜,膜丙为阳离子交换膜,以防 Ⅳ 室的 OH - 通过膜丙进 入 Ⅲ 室与 NaH 2 PO 2 反应消耗原料,同时 Na + 通过膜丙进入 Ⅳ 室可制备浓氢氧化钠溶液,选项 B 错误;
C .由题目信息可知镍应作电解池的阳极,与外接电源的正极相连,选项 C 正确;
D .一段时间后, I 室氢氧根离子放电, c(H + ) 增大, pH 降低, IV 室中氢离子放电, c(OH - ) 增大,溶液的 pH 均升高,选项 D 错误;
答案选 AC ;
(6)
某实验小组利用该装置消耗了氯气 1120mL( 已转化为标准状况, SO 2 足量 ) ,最后得到纯净的磺酰氯 4.0g ,根据反应 SO 2 (g)+Cl 2 (g)=SO 2 Cl 2 ,则磺酰氯的产率为 =59.3% 。