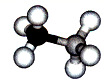
(1) 氨硼烷的晶体类型为 _______ 。
(2) 氨硼烷分子中氮原子、硼原子的杂化轨道类型分别为 _______ , _______
(3) 氨硼烷晶体中存在的作用力有 _______ ( 填序号 )
A 离子键 B 极性键 C 非极性键 D 配位键 E 金属键 F 氢键 G 范德华力
(4) 以 NaBH 4 为硼源、某配合物为氨源可用于制备氨硼烷 . 为测定该配合物的结构,取 2.32g 配合物进行如下实验:用重量法分析金属元素,测得镍元素的质量为 0.59g ;在碱性条件下加热蒸出 NH 3 ,用滴定法测出其物质的量为 0.06mol ;滴加过量硝酸银溶液,有白色沉淀生成,加热,沉淀没有增加;用摩尔法分析含量,测得氯元素质量为 0.71g 。
①该配合物中镍离子的基态电子排布式为 _______ 。
②该配合物的结构简式为 _______ 。
答案
【详解】
(1) 根据球棍模型可知,氨硼烷的结构简式为 BH 3 NH 3 ,氨硼烷的分子结构和乙烷相似,是四面体结构,属于分子晶体;
(2) 氨硼烷分子中 N 原子、 B 原子有三个单电子,均形成单键,由球棍模型可知,是四面体结构,因此它们的杂化轨道类型都是 sp 3 杂化;
(3) 氨硼烷中, B 与 H 、 N 与 H 之间为极性共价键, B 与 N 之间存在配位键,氨硼烷分子之间为范德华力,故选 BDG ;
(4) 用重量法分析金属元素,测得镍元素的质量为 0.59g ,物质的量为 =0.01mol ,在碱性条件下加热蒸出 NH 3 ,用滴定法测出其物质的量为 0.06mol ,质量为 17g/mol×0.06mol=1.02g ,用摩尔法分析含量,测得氯元素质量为 0.71g ,物质的量为
=0.02mol ,所以分子中 Ni 、 Cl 、 NH 3 的比例为 1 : 2 : 6 ,总质量为 0.59g+1.02g+0.71g=2.32g ,故该分子为 [Ni(NH 3 ) 6 ]Cl 2 ;
①根据上述分析,镍离子为 Ni 2+ , Ni 是 28 号元素,离子的基态电子排布式为 1s 2 2s 2 2p 6 3s 2 3p 6 3d 8 ;
②根据上述分析,该配合物的结构简式为 [Ni(NH 3 ) 6 ]Cl 2 。
