A . NaCl 、 HCl B . CO 2 、 SiO 2 C . SO 2 、 H 2 O D . NH 4 Cl 、 CCl 4
【详解】
A. NaCl 中只有离子键、属于离子晶体, HCl 分子内只有共价键、属于分子晶体,化学键类型和晶体类型都不同, A 不符合题意;
B. CO 2 、 SiO 2 内存在的化学键均只有共价键,干冰是分子晶体,二氧化硅是原子晶体, B 符合题意; .
C. SO 2 、 H 2 O 内存在的化学键均只有共价键,构成的都是分子晶体, C 不符合题意; .
D. NH 4 Cl 中有离子键和共价键、属于离子晶体, CCl 4 分子内只有共价键、属于分子晶体,化学键类型和晶体类型都不同, D 不符合题意;
答案选 B 。
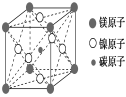
A . Mg 2 CNi 3 B . MgCNi 2
C . MgCNi 3 D . MgC 2 Ni
【详解】
碳原子位于该晶胞的体心上,所以该晶胞中含有一个碳原子;镁原子个数 =8× =1 ,所以该晶胞含有 1 个镁原子;镍原子个数 =6×
=3 ,该晶胞中含有 3 个镍原子,所以该晶胞的化学式为: MgCNi 3 ,故答案为 C 。
【点睛】
均摊法确定立方晶胞中粒子数目的方法是: ①顶点:每个顶点的原子被 8 个晶胞共有,所以晶胞对顶点原子只占 份额; ②棱:每条棱的原子被 4 个晶胞共有,所以晶胞对顶点原子只占
份额; ③面上:每个面的原子被 2 个晶胞共有,所以晶胞对顶点原子只占
份额; ④内部:内部原子不与其他晶胞分享,完全属于该晶胞。
A . CO 2 与 NO 2 B . AlCl 3 与 C 2 H 2
C . H 2 O 与 BF 3 D . CH 4 与 NH 3
【详解】
A. CO 2 含有 2 个 σ 键,孤电子对为 0 ,杂化类型为 sp , NO 2 含有 2 个 σ 键,孤电子对为 1 ,杂化类型为 sp 2 , A 项错误;
B. AlCl 3 中 Al 含有 3 个 σ 键,孤电子对是 =0 ,杂化类型是 sp 2 ,乙炔空间构型为直线型,因此碳的杂化类型为 sp , B 项错误;
C. H 2 O 中含有 2 个 σ 键,孤电子对为 =2 ,杂化类型为 sp 3 , BF 3 中 B 含有 3 个 σ 键,孤电子对为
=0 ,杂化类型为 sp 2 , C 项错误;
D. CH 4 中 C 含有 4 个 σ 键,无孤电子对,杂化类型为 sp 3 , NH 3 中 N 含有 3 个 σ 键,孤电子对为 1 ,杂化类型是为 sp 3 , D 项正确;
答案选 D 。
【点睛】
中心原子上的孤电子对参与互相排斥,价层电子对个数 =σ 键个数 + 孤电子对个数, σ 键个数 = 配原子个数,孤电子对个数 = (a-xb) , a 指中心原子价电子个数, x 指配原子个数, b 指配原子形成稳定结构需要的电子个数。
A . BF 3 与 PCl 3 为三角锥形 B . SO 3 与 CO 3 2- 为平面三角形
C . SO 2 键角大于 120 o D . BF 3 是三角锥形分子
【详解】
A. BF 3 中中心 B 价层电子对个数为 3+ (3-3×1)=3 ,无孤电子对,是平面三角形分子,键角为 120° , A 项错误;
B. SO 3 与 CO 3 2- 中心原子价电子对数均为 3 ,无孤电子对,都是平面三角形的分子, B 项正确;
C. SO 2 中中心 S 原子价层电子对个数为 2+ (6-2×2)=3 ,且 S 原子上含有 1 个孤对电子对,所以 SO 2 为 V 形分子,键角小于 120 o , C 项错误;
D. BF 3 中中心 B 价层电子对个数为 3+ (3-3×1)=3 ,无孤电子对,是平面三角形分子,键角为 120° , D 项错误;
答案选 B 。
A . 是极性分子,分子中氮原子是在 3 个氢原子所构成的三角形的中心
B . 是非极性分子,分子中碳原子处在 4 个氯原子所构成的正方形的中心
C . 是极性分子,分子中氧原子不处在 2 个氢原子所连成的直线的中间
D . 是非极性分子,分子中碳原子不处在 2 个氧原子所连成的直线的中间
【详解】
A . N 与 3 个 H 形成 3 个 键,孤电子对数为
,为三角锥形结构、极性分子,故 A 项错误;
B . 中 C 与 4 个
形成 4 个
键,孤电子对数为 0 ,为正四面体形结构、非极性分子,故 B 项错误;
C . 中 O 与 2 个 H 形成 2 个
键,孤电子对数为
,为角形结构、极性分子,故 C 项正确;
D . 中 C 与 2 个 O 形成 2 个
键,孤电子对数为
,为直线形结构、非极性分子,故 D 项错误;
故选 C 。
本卷还有20题,登录并加入会员即可免费使用哦~

该作品由: 用户王小军分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。