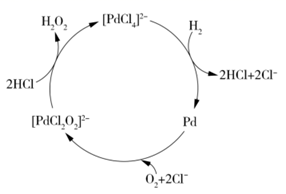
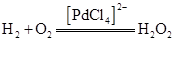A . CO 2 与 NO 2 B . AlCl 3 与 C 2 H 2
C . H 2 O 与 BF 3 D . CH 4 与 NH 3
答案
【详解】
A. CO 2 含有 2 个 σ 键,孤电子对为 0 ,杂化类型为 sp , NO 2 含有 2 个 σ 键,孤电子对为 1 ,杂化类型为 sp 2 , A 项错误;
B. AlCl 3 中 Al 含有 3 个 σ 键,孤电子对是 =0 ,杂化类型是 sp 2 ,乙炔空间构型为直线型,因此碳的杂化类型为 sp , B 项错误;
C. H 2 O 中含有 2 个 σ 键,孤电子对为 =2 ,杂化类型为 sp 3 , BF 3 中 B 含有 3 个 σ 键,孤电子对为
=0 ,杂化类型为 sp 2 , C 项错误;
D. CH 4 中 C 含有 4 个 σ 键,无孤电子对,杂化类型为 sp 3 , NH 3 中 N 含有 3 个 σ 键,孤电子对为 1 ,杂化类型是为 sp 3 , D 项正确;
答案选 D 。
【点睛】
中心原子上的孤电子对参与互相排斥,价层电子对个数 =σ 键个数 + 孤电子对个数, σ 键个数 = 配原子个数,孤电子对个数 = (a-xb) , a 指中心原子价电子个数, x 指配原子个数, b 指配原子形成稳定结构需要的电子个数。