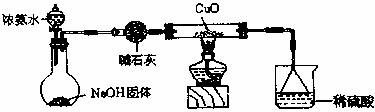
在实验室采用如图所示装置进行气体的制备、收集、尾气处理,合理的是
A . 用氢氧化钙与氯化铵制备氨气 B . 用浓硝酸与铝制备二氧化氮
C . 用二氧化锰与浓盐酸制备氯气 D . 用 70% 浓硫酸与亚硫酸钠制备二氧化硫
答案
D
【详解】
A .用氢氧化钙和氯化铵制备氨气时,氢氧化钙和氯化铵均为固体,故不采用该装置,故 A 错误;
B .常温下,铝的表面被浓硝酸氧化,生成一层致密的氧化物薄膜,这层膜会阻止酸与内层金属的进一步反应,故不能用浓硝酸与铝制备二氧化氮,故 B 错误;
C .二氧化锰与浓盐酸在加热条件下反应制备氯气,常温下不反应,故 C 错误;
D .浓硫酸与亚硫酸钠反应的化学方程式为: H 2 SO 4 +Na 2 SO 3 =Na 2 SO 4 +H 2 O+SO 2 ↑ ,二氧化硫密度比空气大且不与空气反应,故可采用向上排空气法收集,当集气瓶中收集满二氧化硫后,多余的二氧化硫会被氢氧化钠溶液吸收,故该装置可以用于 70% 浓硫酸与亚硫酸钠制备二氧化硫,故 D 正确;
答案选 D 。

 ,结构式为
,结构式为 ,氨分子的结构为三角锥形,N原子位于锥顶,三个H原子位于锥底,键角107°18′,是极性分子。 分子结构为:
,氨分子的结构为三角锥形,N原子位于锥顶,三个H原子位于锥底,键角107°18′,是极性分子。 分子结构为:






 ,氨的水溶液叫做氨水。在氨水中所含的微粒有:
,氨的水溶液叫做氨水。在氨水中所含的微粒有:
 氨水具有碱的通性,如能使无色酚酞溶液变红。
氨水具有碱的通性,如能使无色酚酞溶液变红。 

 (工业制HNO3的基础反应)
(工业制HNO3的基础反应) (Cl2过量)
(Cl2过量) (NH3过量,可用于检验Cl2瓶是否漏气)
(NH3过量,可用于检验Cl2瓶是否漏气)  (实验室制N2)
(实验室制N2)
 (治理氮氧化物污染)
(治理氮氧化物污染) 

 的比较:
的比较:


 固体混合反应,加热时反应速率显著增大。因为
固体混合反应,加热时反应速率显著增大。因为 在加热时可能发生爆炸性的分解反应:
在加热时可能发生爆炸性的分解反应:
 ,若用硝铵代替,在制氨气过程中可能会发生危险;因为碳铵受热极易分解出CO2:,使生成的NH3中混有较多CO2杂质,故不用碳铵;若用硫铵,由于反应时生成
,若用硝铵代替,在制氨气过程中可能会发生危险;因为碳铵受热极易分解出CO2:,使生成的NH3中混有较多CO2杂质,故不用碳铵;若用硫铵,由于反应时生成 ,易使反应混合物结块,产生的氨气不易逸出。故制NH3时选用
,易使反应混合物结块,产生的氨气不易逸出。故制NH3时选用 。
。  和生石灰(CaO)或烧碱:
和生石灰(CaO)或烧碱: 

 平衡右移,放出
平衡右移,放出 ,且NaOH、CaO溶于水均放热,可降低
,且NaOH、CaO溶于水均放热,可降低 ,在水中的溶解度。
,在水中的溶解度。  溶于水或使尿素在碱性条件下水解。
溶于水或使尿素在碱性条件下水解。 
 、无水
、无水 等作干燥剂,因为它们均能与NH3发生反应。
等作干燥剂,因为它们均能与NH3发生反应。