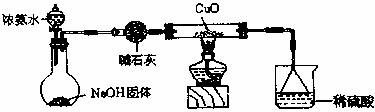
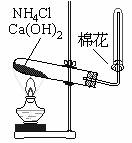
某同学在实验室制氨气时进行下列实验设计。
(1)实验室制氨气的原理(写化学方程式): ,氨气的电子式为: ,氨气分子的空间构型是: 。
(2)实验室制氨气的发生装置与制 气体完全相同。(填化学式)
(3)将制备的氨经 干燥后,在催化氧化制硝酸时出现白烟,试解释:(用相关化学方程式表示)
。
答案
(1) 实验室制氨气的原理(写化学方程式):
2NH4Cl+Ca(OH)2![]() CaCl2+2NH3+2H2O 氨气电子式为: _略 ,
CaCl2+2NH3+2H2O 氨气电子式为: _略 ,
氨气分子的空间构型是:三角雏形。
(2) O2 。(填化学式)
(3) 氨经 碱石灰 (名称)干燥后,在催化氧化制硝酸时出现白烟,试解释:(用相关化学方程式表示)
4NH3+5O2![]() 4NO+6H2O 2NO+O2=2NO2
4NO+6H2O 2NO+O2=2NO2
3NO2+H2O==3HNO3+NO NH3+HNO3=NH4NO3

 ,结构式为
,结构式为 ,氨分子的结构为三角锥形,N原子位于锥顶,三个H原子位于锥底,键角107°18′,是极性分子。 分子结构为:
,氨分子的结构为三角锥形,N原子位于锥顶,三个H原子位于锥底,键角107°18′,是极性分子。 分子结构为:






 ,氨的水溶液叫做氨水。在氨水中所含的微粒有:
,氨的水溶液叫做氨水。在氨水中所含的微粒有:
 氨水具有碱的通性,如能使无色酚酞溶液变红。
氨水具有碱的通性,如能使无色酚酞溶液变红。 

 (工业制HNO3的基础反应)
(工业制HNO3的基础反应) (Cl2过量)
(Cl2过量) (NH3过量,可用于检验Cl2瓶是否漏气)
(NH3过量,可用于检验Cl2瓶是否漏气)  (实验室制N2)
(实验室制N2)
 (治理氮氧化物污染)
(治理氮氧化物污染) 

 的比较:
的比较:


 固体混合反应,加热时反应速率显著增大。因为
固体混合反应,加热时反应速率显著增大。因为 在加热时可能发生爆炸性的分解反应:
在加热时可能发生爆炸性的分解反应:
 ,若用硝铵代替,在制氨气过程中可能会发生危险;因为碳铵受热极易分解出CO2:,使生成的NH3中混有较多CO2杂质,故不用碳铵;若用硫铵,由于反应时生成
,若用硝铵代替,在制氨气过程中可能会发生危险;因为碳铵受热极易分解出CO2:,使生成的NH3中混有较多CO2杂质,故不用碳铵;若用硫铵,由于反应时生成 ,易使反应混合物结块,产生的氨气不易逸出。故制NH3时选用
,易使反应混合物结块,产生的氨气不易逸出。故制NH3时选用 。
。  和生石灰(CaO)或烧碱:
和生石灰(CaO)或烧碱: 

 平衡右移,放出
平衡右移,放出 ,且NaOH、CaO溶于水均放热,可降低
,且NaOH、CaO溶于水均放热,可降低 ,在水中的溶解度。
,在水中的溶解度。  溶于水或使尿素在碱性条件下水解。
溶于水或使尿素在碱性条件下水解。 
 、无水
、无水 等作干燥剂,因为它们均能与NH3发生反应。
等作干燥剂,因为它们均能与NH3发生反应。