实验室用下图装置实现氨与灼热的 CuO 反应制得金属铜。 A 中加入的是氯化铵和某种碱的固体混合物,回答下列问题:
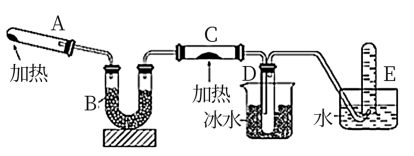
(1)A 中制取氨气的反应方程式为 ______ 。
(2)B 中加入的物质是 _____ ( 填名称 ) 。
(3) 实验时 C 中观察到的现象是 _____ ,其反应的方程式为 _____ 。
(4) 实验时在 D 中收集到的液态物质是 ____ ( 填名称 ) 。
(5) 已知反应前 C 中固体的质量为 m 1 g ,反应一段时间后停止反应,冷却至室温测量 C 中固体的质量为 m 2 g ,则理论上 E 中最多收集到的气体体积为 ___ ( 换算成标准状况下的体积 )L( 用 m 1 、 m 2 表示 ) 。
答案
2NH 4 Cl+Ca(OH) 2 CaCl 2 +2NH 3 ↑ +2H 2 O 碱石灰 黑色固体逐渐变成红色 2NH 3 +3CuO
N 2 +3H 2 O+3Cu 氨水
【分析】
氯化铵与氢氧化钙在加热条件下生成氨气、氯化钙和水, B 为干燥氨气的装置,依据氨气的性质选择干燥剂, C 装置中氨气还原氧化铜反应生成铜、氮气和水,氨气易液化,极易吸收水成为氨水,氨水具有碱性,能使红色石蕊试纸变蓝,其中的结晶水会使无水硫酸铜变蓝,据此解答。
【详解】
(1) 实验室用氯化铵和氢氧化钙加热制取氨气,反应方程式为: 2NH 4 Cl+Ca(OH) 2 CaCl 2 +2NH 3 ↑ +2H 2 O ,故答案为: 2NH 4 Cl+Ca(OH) 2
CaCl 2 +2NH 3 ↑ +2H 2 O ;
(2) A 中反应过程中生成水蒸气,水蒸气影响 C 中反应,所以 B 的目的干燥氨气,但不能和氨气反应,应该用碱性物质,为碱石灰,故答案为:碱石灰;
(3) 根据 2NH 3 +3CuO N 2 +3H 2 O+3Cu 知, C 中黑色固体 CuO 变为红色 Cu ,所以看到的现象是黑色固体逐渐变成红色,故答案为:黑色固体逐渐变成红色; 2NH 3 +3CuO
N 2 +3H 2 O+3Cu ;
(4) 冰水混合物能使水蒸气冷却变成液态,氨气极易溶于水,所以 D 中得到的物质是氨水,故答案为:氨水;
(5)E 中收集的气体是氮气,根据 2NH 3 +3CuO N 2 +3H 2 O+3Cu 知,减少的质量为 O 原子的质量,设收集到的气体体积为 x ,则 x=
,故答案为:
。

 ,结构式为
,结构式为 ,氨分子的结构为三角锥形,N原子位于锥顶,三个H原子位于锥底,键角107°18′,是极性分子。 分子结构为:
,氨分子的结构为三角锥形,N原子位于锥顶,三个H原子位于锥底,键角107°18′,是极性分子。 分子结构为:






 ,氨的水溶液叫做氨水。在氨水中所含的微粒有:
,氨的水溶液叫做氨水。在氨水中所含的微粒有:
 氨水具有碱的通性,如能使无色酚酞溶液变红。
氨水具有碱的通性,如能使无色酚酞溶液变红。 

 (工业制HNO3的基础反应)
(工业制HNO3的基础反应) (Cl2过量)
(Cl2过量) (NH3过量,可用于检验Cl2瓶是否漏气)
(NH3过量,可用于检验Cl2瓶是否漏气)  (实验室制N2)
(实验室制N2)
 (治理氮氧化物污染)
(治理氮氧化物污染) 

 的比较:
的比较:


 固体混合反应,加热时反应速率显著增大。因为
固体混合反应,加热时反应速率显著增大。因为 在加热时可能发生爆炸性的分解反应:
在加热时可能发生爆炸性的分解反应:
 ,若用硝铵代替,在制氨气过程中可能会发生危险;因为碳铵受热极易分解出CO2:,使生成的NH3中混有较多CO2杂质,故不用碳铵;若用硫铵,由于反应时生成
,若用硝铵代替,在制氨气过程中可能会发生危险;因为碳铵受热极易分解出CO2:,使生成的NH3中混有较多CO2杂质,故不用碳铵;若用硫铵,由于反应时生成 ,易使反应混合物结块,产生的氨气不易逸出。故制NH3时选用
,易使反应混合物结块,产生的氨气不易逸出。故制NH3时选用 。
。  和生石灰(CaO)或烧碱:
和生石灰(CaO)或烧碱: 

 平衡右移,放出
平衡右移,放出 ,且NaOH、CaO溶于水均放热,可降低
,且NaOH、CaO溶于水均放热,可降低 ,在水中的溶解度。
,在水中的溶解度。  溶于水或使尿素在碱性条件下水解。
溶于水或使尿素在碱性条件下水解。 
 、无水
、无水 等作干燥剂,因为它们均能与NH3发生反应。
等作干燥剂,因为它们均能与NH3发生反应。