铜与浓硝酸反应生成 NO 2 ,浓硝酸变稀后生成 NO( 沸点为 −151 ℃ ) ,某探究小组由这一实验事实出发,猜测碳与浓硝酸反应生成 NO 2 ,浓硝酸变稀后生成 NO ,并设计如图所示装置进行验证 ( 加热和尾气处理装置、夹持仪器均已略去 ) 。回答下列问题:
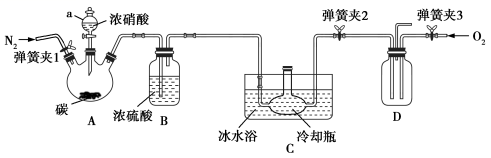
(1) 仪器 a 的名称为 _______ ; N 2 的作用除将装置内空气排尽外,还有 _______ 。
(2) 打开弹簧夹 1 、 2 ,在持续通入 N 2 的条件下,先把碳加热至红热后停止加热,再缓慢滴入浓硝酸的原因为 _______ ;反应产生的气体干燥后进入装置 C 的冷却瓶,气体颜色变浅接近于无色,其原因为 _______ ;一段时间后,打开弹簧夹 3 ,通入 O 2 ,冷却瓶中气体进入装置 D 后气体颜色仍无明显变化,说明该小组的猜测 _______ ( 填 “ 正确 ” 或 “ 错误 ”) 。
(3) 该小组对上面装置进行改进,验证碳被浓硝酸氧化的产物为 CO 2 ( 加热装置和夹持仪器已略去 ) 。
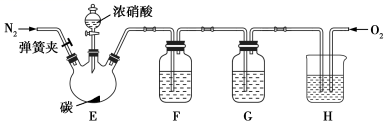
已知: NO 2 能与 NaOH 溶液反应, NO 不能与 NaOH 溶液反应。
①装置 F 、 G 中的试剂可以分别选用 _______ 、 _______ ( 填标号 ) 。
a. 蒸馏水 b.NaOH 溶液 c.Na 2 CO 3 溶液 d. 澄清石灰水
②装置 H 中盛有 NaOH 溶液,向其中通入足量氧气进行尾气处理,生成 NaNO 3 ,该反应的离子方程式为 _______ 。
答案
分液漏斗 将气体产物吹入后续装置中 浓硝酸受热分解,无法确保浓硝酸与碳反应 红棕色 NO 2 在冰水浴条件下转化为无色的 N 2 O 4 错误 a d 4NO+3O 2 +4OH − =4 +2H 2 O
【详解】
(1) 根据仪器构造可知,仪器 a 为分液漏斗;由于本实验需验证有无 NO 产生,空气中的 O 2 能氧化 NO ,所以用 N 2 先将装置内空气排尽,并将气体产物吹入后续装置中,故答案为:分液漏斗;将气体产物吹入后续装置中;
(2) 浓硝酸受热时分解,浓度减小,无法确保加入的浓硝酸与碳反应,所以先将碳加热至红热,再缓慢滴入浓硝酸;气体颜色变浅是因为 NO 2 转化为 N 2 O 4 的反应为放热反应,在冰水浴条件下大部分红棕色的 NO 2 转化为无色的 N 2 O 4 ,使气体颜色变浅并接近于无色;若猜测正确, NO 遇 O 2 会生成红棕色 NO 2 , D 装置中气体颜色应该有明显变化,从颜色无明显变化可推知该猜测是错误的,故答案为:浓硝酸受热分解,无法确保浓硝酸与碳反应;红棕色 NO 2 在冰水浴条件下转化为无色的 N 2 O 4 ;错误;
(3) ① Ca(OH) 2 微溶,澄清石灰水中 Ca(OH) 2 的量很少,装置 F 中可盛有蒸馏水,将 NO 2 转化为 NO ,防止 NO 2 与水生成 HNO 3 对 CO 2 的检验造成干扰, G 中的试剂为检验 CO 2 的澄清石灰水,故答案为: a ; d ;
② NaOH 、 NO 与 O 2 反应生成 NaNO 3 ,利用化合价升降法进行氧化还原反应方程式配平,离子方程式为 4NO+3O 2 +4OH − ![]() 4
4 +2H 2 O 。

 (实验室制CO2气体时,若无稀盐酸可用稀硝酸代替)
(实验室制CO2气体时,若无稀盐酸可用稀硝酸代替)



 等,应注意的是NO3-无氧化性,而当NO3-在酸性溶液中时,则具有强氧化性。例如,在Fe(NO3)2溶液中加入盐酸或硫酸,因引入了H+而使Fe2+被氧化为Fe3+;又如,向浓HNO3与足量的Cu反应后形成的Cu(NO3)2中再加入盐酸或硫酸,则剩余的Cu会与后来新形成的稀HNO3继续反应。 F. 能氧化并腐蚀某些有机物,如皮肤、衣服、纸张、橡胶等。因此在使用硝酸(尤其是浓硝酸)时要特别小心,万一不慎将浓硝酸弄到皮肤上,应立即用大量水冲洗,再用小苏打或肥皂液洗涤。
等,应注意的是NO3-无氧化性,而当NO3-在酸性溶液中时,则具有强氧化性。例如,在Fe(NO3)2溶液中加入盐酸或硫酸,因引入了H+而使Fe2+被氧化为Fe3+;又如,向浓HNO3与足量的Cu反应后形成的Cu(NO3)2中再加入盐酸或硫酸,则剩余的Cu会与后来新形成的稀HNO3继续反应。 F. 能氧化并腐蚀某些有机物,如皮肤、衣服、纸张、橡胶等。因此在使用硝酸(尤其是浓硝酸)时要特别小心,万一不慎将浓硝酸弄到皮肤上,应立即用大量水冲洗,再用小苏打或肥皂液洗涤。 


 等,这取决于硝酸的浓度和还原剂还原性的强弱。除前面的实例外,锌与硝酸可发生如下反应:
等,这取决于硝酸的浓度和还原剂还原性的强弱。除前面的实例外,锌与硝酸可发生如下反应:
