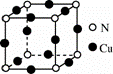
按要求填空 :
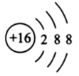
( 1 )质量数为 37 的氯原子符号为 _____ 。 S 2- 的结构示意图 ___ 。
( 2 ) NH 的电子式 ______ 。磷原子的核外电子排布式 _____ ,价电子排布图 _____ 。
( 3 ) X 射线衍射测定等发现, I 3 AsF 6 中存在 I 离子。 I
离子的几何构型为 ____ 。
( 4 )与 O 3 分子互为等电子体的一种阴离子为 _______ (填化学式)。 H 、 C 、 O 、 N 第一电离能由大到小的顺序是 ________ (填元素符号)。
( 5 ) F 2 中 F-F 键的键能( 157kJ/mol )小于 Cl 2 中 Cl-C1 键的键能( 242.7kJ/mol ),原因是 _____ 。 基态 S 原子电子占据最高能级的电子云轮廓图为 _____ 形。
答案
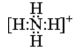 [Ne]3s 2 sp 3
[Ne]3s 2 sp 3 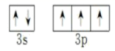 V 形
V 形 N>O>C>H F 原子半径较小,孤电子对间的排斥力大 哑铃
【详解】
( 1 )氯原子的质子数为 17 ,质量数为 37 ,符号为 ; S 原子得 2 个电子形成 S 2- , S 2- 的结构示意图为
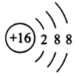 ;
;
( 2 ) NH 中 N 与每个 H 之间都有一对共用电子对,电子式为
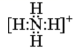 ; P 有 15 个电子,核外电子排布式为 [Ne]3s 2 sp 3 ;价电子为 3s 2 sp 3 ,价电子排布图为
; P 有 15 个电子,核外电子排布式为 [Ne]3s 2 sp 3 ;价电子为 3s 2 sp 3 ,价电子排布图为 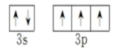 ;
;
( 3 ) I 离子可看做二碘化碘离子,
,两个碘分别为 +3 价和 -1 价,中心原子的价层电子对数为 2+
=4 ,中心原子的孤电子对数为 2 ,空间构型为 V 形;
( 4 )等电子体是指价电子数和原子数相同的分子、离子或原子团,与 O 3 分子互为等电子体的一种阴离子为 ;同周期从左向右第一电离能逐渐增大,但 IIA>IIIA , VA>VIA ,即 N 的第一电离能大于 O ,故 H 、 C 、 O 、 N 第一电离能由大到小的顺序是 N>O>C>H ;
( 5 )一般而言,原子半径越小,共价鍵的键能越大,但 F 2 中 F 原子半径较小,孤电子对间的排斥力大,使 F 2 中 F-F 键的键能小于 Cl 2 中 Cl-Cl 键的键能; S 的核外电子排布式为 [Ne]3s 2 3p 4 ,最高能级为 3p , p 轨道的电子云轮廓为哑铃形;


 )、半充满(
)、半充满( )和全空(
)和全空(
 )状态时,体系的能量较低,原子较稳定。
)状态时,体系的能量较低,原子较稳定。