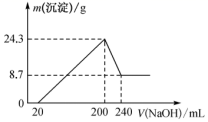
将一定质量的镁铝合金投入一定体积 10 mol · L - 1 的盐酸中,固体全部溶解后,向所得溶液中加入 NaOH 溶液,生成沉淀的质量与加入 NaOH 溶液的体积关系如图所示。若不考虑金属和盐酸反应时 HCl 的挥发,则下列说法不正确的是
A . 该镁铝合金中铝的质量为 5 . 4 g
B . 所用 NaOH 物质的量浓度为 4 . 5 mol · L - 1
C . 反应中沉淀的物质的量最多时为 0 . 35 mol
D . 溶解合金所用盐酸的体积为 100 mL
答案
B
【分析】
从图象可知,从开始至加入 NaOH 溶液 20mL ,没有沉淀生成,说明原溶液中盐酸溶解 Mg 、 Al 后有剩余,此时发生的反应为 HCl + NaOH = NaCl + H 2 O ,当 V ( NaOH )= 200mL 时,沉淀量最大,此时为 Mg ( OH ) 2 和 Al ( OH ) 3 ;当 V ( NaOH )= 240mL 时,沉淀不再减少,此时全部为 Mg ( OH ) 2 。从 200mL 到 240mL , NaOH 溶解 Al ( OH ) 3 : NaOH + Al ( OH ) 3 = NaAlO 2 + 2H 2 O ,根据各阶段各物质的量进行计算和判断。
【详解】
A .根据图像可知生成的氢氧化铝的质量是 24 . 3g - 8 . 7g = 15 . 6g ,物质的量是 15 . 6g ÷ 78g / mol = 0 . 2mol ,根据铝原子守恒可知该镁铝合金中铝的质量为 0 . 2mol × 27g / mol = 5 . 4 g , A 正确;
B .溶解 0 . 2mol 氢氧化铝消耗氢氧化钠溶液是 40mL ,根据方程式 NaOH + Al ( OH ) 3 = NaAlO 2 + 2H 2 O 可知消耗氢氧化钠的物质的量是 0 . 2mol ,则所用 NaOH 物质的量浓度为 0 . 2mol ÷ 0 . 04L = 5 mol · L - 1 , B 错误;
C .氢氧化镁的质量是 8 . 7g ,物质的量是 8 . 7g ÷ 58g / mol = 0 . 15mol ,则反应中沉淀的物质的量最多时为 0 . 15mol + 0 . 2mol = 0 . 35 mol , C 正确;
D .当开始产生沉淀时溶液中的溶质是氯化镁、氯化铝和氯化钠,溶液中氯离子的物质的量是 0 . 15mol × 2 + 0 . 2mol × 3 + 0 . 02L × 5mol / L = 1 . 0mol ,则溶解合金所用盐酸的体积为 1mol ÷ 10mol / L = 0 . 1L = 100 mL , D 正确;
答案选 B 。
