下列实验中金属或氧化物可以完全溶解的是
A . 1mol Cu 与含 2mol H 2 SO 4 的浓硫酸共热
B . 1mol MnO 2 与含 2mol H 2 O 2 的溶液共热
C . 常温下 1mol Al 投入足量的浓硫酸中
D . 常温下 1mol Cu 投入含 4mol HNO 3 的浓硝酸中
D
【详解】
A . 1mol Cu 与含 2mol H 2 SO 4 的浓硫酸共热,化学方程式为 Cu+2H 2 SO 4 ( 浓 ) CuSO 4 +SO 2 ↑+2H 2 O ,随着反应的进行浓硫酸逐渐变为稀硫酸,稀硫酸不与铜反应, Cu 不能完全溶解,故 A 错误;
B . 1mol MnO 2 与含 2mol H 2 O 2 的溶液共热, MnO 2 作催化剂,使得 H 2 O 2 分解成水合氧气,故 MnO 2 不会溶解在 H 2 O 2 中,故 B 错误;
C .常温下 Al 遇浓硫酸钝化,表面形成致密的氧化膜,阻止反应继续进行,则 Al 不能完全溶解,金属过量,故 C 错误;
D .随着反应的进行浓硝酸逐渐变为稀硝酸,但稀硝酸也与铜反应, Cu+4HNO 3 ( 浓 )=Cu(NO 3 ) 2 +2H 2 O+2NO 2 ↑ 、 3Cu+8HNO 3 ( 稀 )=3Cu(NO 3 ) 2 +4H 2 O+2NO↑ , Cu 可以完全溶解,故 D 正确;
答案选 D 。
对下列事实的解释错误的是
A . 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
B . 浓硝酸在光照下颜色变黄,说明浓硝酸不稳定
C . 常温下,浓硝酸可以用铝制器皿贮存,说明铝与浓硝酸不反应
D . 将 SO 2 通入 BaCl 2 溶液至饱和,未见沉淀生成,继续通入另一种气体,有白色沉淀,则通入的气体可能是 NH 3
C
【详解】
A .浓硫酸能按水的组成比脱去蔗糖中的氢、氧元素,使蔗糖出现发黑现象,证明浓硫酸具有脱水性, A 正确;
B .浓硝酸在光照条件下分解生成二氧化氮、氧气和水,二氧化氮为红棕色气体,溶于硝酸使溶液呈黄色, B 正确;
C .铝和浓硝酸反应生成一层致密的氧化物薄膜,阻止了进一步的反应, C 错误;
D .亚硫酸酸性弱于盐酸,故将 SO 2 通入 BaCl 2 溶液至饱和,未见沉淀生成,继续通入另一种气体,有白色沉淀,则是钡盐沉淀,若通入 NH 3 ,氨气、二氧化硫和水反应生成铵根、亚硫酸根离子,亚硫酸根离子被钡离子沉淀为亚硫酸钡, D 正确;
答案为 C 。
下列有关化学反应的叙述正确的是
A . 常温下, Mg 在 CO 2 中燃烧生成 MgCO 3
B . 常温下,铁分别与稀盐酸和氯气反应,产物中铁元素的化合价相同
C . 常温下, Al 在氢氧化钠溶液中反应会产生气体
D . 常温下, Ag 在浓硝酸中发生钝化
C
【详解】
A . Mg 与二氧化碳反应生成 MgO 、 C ,不能生成 MgCO 3 ,故 A 错误;
B . Fe 与盐酸反应生成氯化亚铁, Fe 与氯气反应生成氯化铁,与 HCl 、氯气的氧化性有关, Fe 元素的化合价分别为 +2 、 +3 价,故 B 错误;
C . Al 与 NaOH 溶液反应生成氢气,会产生气体,故 C 正确;
D .常温下 Fe 、 Al 在浓硝酸中发生钝化,而 Ag 不能发生钝化,故 D 错误;
答案选 C 。
中国青铜器在世界上享有极高声誉。所谓青铜是铜与锡或铅等元素按一定比例熔铸而成的,颜色呈青,故名青铜。青铜器在外界环境影响下所形成的腐蚀产物,由内向外为 CuCl 、 Cu 2 O ,再向外是 CuCO 3 · 3Cu ( OH ) 2 或 CuCl 2 · 3Cu ( OH ) 2 ,或两者都有的层叠状结构。下列说法中错误的是 ( )
A. 青铜属于铜的一种合金,具有较高硬度
B . 加入锡或铅可以降低 “熔铸”时所需温度
C . 青铜的主要成分为铜,铜通常呈现青色
D . 青铜器外层的腐蚀物与空气中的氧气有关
C
【详解】
A .青铜是铜与锡或铅等元素按一定比例熔铸而成的,因此青铜属于铜的一种合金,具有较高硬度, A 正确;
B .合金的熔点一般低于各成分金属的熔点,因此加入锡或铅可以降低 “熔铸”时所需温度, B 正确;
C .青铜的主要成分为铜,铜通常呈现红色, C 错误;
D .在潮湿的空气中铜易被氧气氧化,因此青铜器外层的腐蚀物与空气中的氧气有关, D 正确;
答案选 C 。
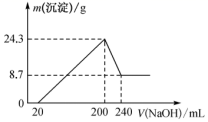
将一定质量的镁铝合金投入一定体积 10 mol · L - 1 的盐酸中,固体全部溶解后,向所得溶液中加入 NaOH 溶液,生成沉淀的质量与加入 NaOH 溶液的体积关系如图所示。若不考虑金属和盐酸反应时 HCl 的挥发,则下列说法不正确的是
A . 该镁铝合金中铝的质量为 5 . 4 g
B . 所用 NaOH 物质的量浓度为 4 . 5 mol · L - 1
C . 反应中沉淀的物质的量最多时为 0 . 35 mol
D . 溶解合金所用盐酸的体积为 100 mL
B
【分析】
从图象可知,从开始至加入 NaOH 溶液 20mL ,没有沉淀生成,说明原溶液中盐酸溶解 Mg 、 Al 后有剩余,此时发生的反应为 HCl + NaOH = NaCl + H 2 O ,当 V ( NaOH )= 200mL 时,沉淀量最大,此时为 Mg ( OH ) 2 和 Al ( OH ) 3 ;当 V ( NaOH )= 240mL 时,沉淀不再减少,此时全部为 Mg ( OH ) 2 。从 200mL 到 240mL , NaOH 溶解 Al ( OH ) 3 : NaOH + Al ( OH ) 3 = NaAlO 2 + 2H 2 O ,根据各阶段各物质的量进行计算和判断。
【详解】
A .根据图像可知生成的氢氧化铝的质量是 24 . 3g - 8 . 7g = 15 . 6g ,物质的量是 15 . 6g ÷ 78g / mol = 0 . 2mol ,根据铝原子守恒可知该镁铝合金中铝的质量为 0 . 2mol × 27g / mol = 5 . 4 g , A 正确;
B .溶解 0 . 2mol 氢氧化铝消耗氢氧化钠溶液是 40mL ,根据方程式 NaOH + Al ( OH ) 3 = NaAlO 2 + 2H 2 O 可知消耗氢氧化钠的物质的量是 0 . 2mol ,则所用 NaOH 物质的量浓度为 0 . 2mol ÷ 0 . 04L = 5 mol · L - 1 , B 错误;
C .氢氧化镁的质量是 8 . 7g ,物质的量是 8 . 7g ÷ 58g / mol = 0 . 15mol ,则反应中沉淀的物质的量最多时为 0 . 15mol + 0 . 2mol = 0 . 35 mol , C 正确;
D .当开始产生沉淀时溶液中的溶质是氯化镁、氯化铝和氯化钠,溶液中氯离子的物质的量是 0 . 15mol × 2 + 0 . 2mol × 3 + 0 . 02L × 5mol / L = 1 . 0mol ,则溶解合金所用盐酸的体积为 1mol ÷ 10mol / L = 0 . 1L = 100 mL , D 正确;
答案选 B 。
本卷还有45题,登录并加入会员即可免费使用哦~

该作品由: 用户马陈雨分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。